Inscription / Connexion Nouveau Sujet
TP Oxydation du menthol
Bonjour à tous , après avoir fais un TP sur l'oxydation du menthol , j'ai maintenant une série de question a faire relative a ce TP , et je n'y comprend pas grand chose car lors de l’expérience le professeur ne nous a pas vraiment expliqué .
( Les données dont la formule semi développée du menthol ainsi qu'un tableau seront mis en attachement)
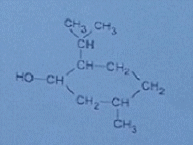
1/ Quelle est la classe de cet alcool ?
En faisant quelques recherches , il y a apparemment les classes primaires , secondaires et tertiaires, et cet alcool serait donc secondaire ?
2/ Que donne l'oxydation ménagée de cette classe d'alcool ?
Cette oxydation nous donne donc une cétone ?
3/ Dessiner l'ampoule a décanter en précisant la nature et la position des phases
Je suppose que la phase aqueuse serait en dessous de la phase organique
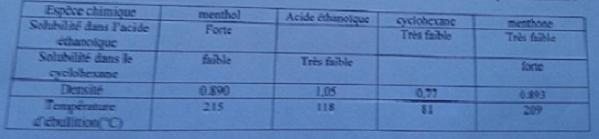
4/ A l'aide du tableau ci dessous , justifier la nature et la position relative des phases dans l'ampoule a décanter
Je sais qu'il y a un rapport avec la densité mais je ne saurais pas le justifier
5/ Proposer une méthode qui permettrait d'extraire le solvant cyclohexane de la phase organique récupérée ( aidez vous du tableau )
Je ne sais vraiment pas
6/ On donne l'équation
5 C10H20O + 2 MnO4- (aq) + 6 H+ (aq)
-> 5 C10H18O + 2Mn2+ (aq) + 8 H2O
Calculer les quantités de matières initiales en menthol et en permanganate de potassium
Déduire d'un tableau d'avancement le réactif limitant
7/ Si on récupère 1.02g de menthone , quel est le rendement de la transformation ?
Données : M(C) = 12 g.mol-1 M(H) = 1.O g.mol-1 M(0) = 16 g.mol -1
J'ai également trouvé que le rendement se calculait de cette façon
Rendement = Rapport de la quantité de produit obtenu expérimentalement nexp à la quantité maximale nmax de produit espéré lors d'une transformation totale
Voila , si vous pouviez m'éclairer pour certaines questions cela me serait d'une très grande aide 
Edit Coll : image recadrée
Bonjour à tous,
Lors d'un TP " Oxydation du menthol " , nous avons du faire ces manipulations
- Dissoudre 5 mL d'acide éthanoïque avec 1.56 g de menthol
- Ajouter 20 mL de permanganate de potassium
- chauffer jusqu'à atteindre 55°C
- Verser le contenu dans l'ampoule à décanter , en rajoutant 10 mL de cyclohexane
Et donc maintenant dans l'ampoule on devrait trouver une phase aqueuse et une phase organique, or je ne sais pas quelles espèces chimiques contiennent chaque phase . Pouvez vous m'éclairer la dessus ?
On me demande ensuite de proposer une méthode qui permettrait d'extraire le solvant cyclohexane de la phase organique récupérée ( donc le cyclohexane serait dans la phase organique ) , a l'aide de ce tableau
Espèce chimique : Menthol acide éthanoïque cyclohexane menthone
Solubilité dans l'acide éthanoïque : forte / très faible très faible
Solubilité dans le cyclohexane : faible tres faible / forte
Densité 0.890 1.05 0.77 0.893
Température d'ébullition 215°C 118°C 81°C 209°C
Un montage a reflux serait-il possible ? Si l'on chauffe a 81°C on pourrait récuperer seulement le cyclohexane ? Ou alors faut-il simplement rajouter l'acide éthanoique puis séparer les 2 ?
Merci d'avance 
*** message déplacé ***


