Inscription / Connexion Nouveau Sujet
TP échange d'énergie (calorimétrie).
Bonjour à tous et à toutes,
Voilà, mon collègue de TP et moi avont un TP de physique à finir mais nous n'y arrivons pas.
Le problème est le suivant :
1) Que vaut la variation d'énergie interne du système eau chaude, eau froide et calorimètre ? (sachant que Qcalorimètre = K( f -
f -  i), où K est la capacité calorifique du calorimètre)
i), où K est la capacité calorifique du calorimètre)
2) En déduire la valeur de K.
Nous avions déjà déterminé auparant la variation d'énergie interne,  U de l'eau chaude (-7,524 J) et celle de l'eau froide (7,524 J).
U de l'eau chaude (-7,524 J) et celle de l'eau froide (7,524 J).
Voilà, voilà, en attente d'une réponse nous vous remerçions !
Bonjour,
La variation d'énergie interne de tout le système est lié à une perte ou à un gain (selon l'expérience) de chaleur Q.
 U = Qcalo donc si vous avez calculé
U = Qcalo donc si vous avez calculé  Utotal et que vous connaissez les températures initiale et finale..
Utotal et que vous connaissez les températures initiale et finale..
Oui, c'est juste que la question est tournée différemment dans le sens suivant :
variation d'énergie interne du système eau chaude, eau froide et calorimètre = 0 =  U_chaude +
U_chaude +  U_froide + Q_calo
U_froide + Q_calo
car le système total est considéré comme isolé dans le TP je suppose non ?
Le calorimètre est considéré comme isolé en effet.
Cependent, pour calculer  U total il nous faut Q calorimètre si je me trompe, et c'est ce que nous cherchons.
U total il nous faut Q calorimètre si je me trompe, et c'est ce que nous cherchons.
De plus,  U eau froide+
U eau froide+ U eau chaude = 0, donc Q calorimètre = 0 ? C'est étrange.
U eau chaude = 0, donc Q calorimètre = 0 ? C'est étrange.
Petite précision supplémentaire : l'eau chaude est passée de 42°c à 33°c et l'eau froide de 21°c à 33°c.

variation d'énergie interne du système TOTAL eau chaude, eau froide et calorimètre = 0
D'autre part,
variation interne totale = U_chaude + U_froide + Q_calo.
Ce serait plus simple de reprendre à zéro en expliquant quel a été le protocole de l'expérience.
Comment vous avez calculé les différentes énergies internes (car en effet, cela signifierai que k=0 ce qui n'a pas de sens) ?
La première manipulation consiste en :
Prélever 150g d'eau du robinet ("eau froide" ici 21°C).
Mettre le vase du calorimètre pendant quelques instants sous l'eau du robinet pour qu'il prenne la température de l'eau.
Mettre l'eau froide dans le calorimètre et mesurer la température de l'ensemble quand le système semble en équilibre
Prélever 200g d'eau à environ 40°c (ici 42°c)
Mettre l'eau chaude dans le calorimètre, homogénéiser le mélange et mesurer la température lorsqu'elle est stabilisée
Ainsi nous avons calculé  U de l'eau froide, soit m x c x (Température finale - température initiale)
U de l'eau froide, soit m x c x (Température finale - température initiale)
Ce qui donne, avec l'eau, 150g x 4.18J/g/K x (33 - 21)
= 0.150 x 4.18 x 12
=7.524 J
De même avec l'eau chaude, on obtient -7.524J
Q1) Donner les expressions des variations d'énergier interne,  U, de l'eau chaude et de l'eau froide. (fait ci-dessus)
U, de l'eau chaude et de l'eau froide. (fait ci-dessus)
Q2)Qcalorimètre est donné par Qcalorimètre = K x (température finale - température initiale), où K est la capacité calorifique du calorimètre. Donner l'unité de K.
Etant donné qu'il s'agit de la capacité calorifique, K est en J/K
Q3) Que vaut la variation d'énergie interne du système eau chaude, eau froide et calorimètre ?
Q4) En déduire la valeur K
Voilà où nous bloquons.
Hum..
Je suis perplexe car je n'ai pas envie de vous induire en erreur.
Pour Q3) la variation d'énergie totale est nulle. Maintenant c'est le fait que vous ayez mesuré  U_froide = -
U_froide = -  U_chaude
U_chaude
qui fait que vous pouvez pas en déduire k par déduction du résultat de cette question Q3.
En revanche, vous pouvez en déduire k en vous restreignant à la première étape.
car vous savez que l'énergie gagnée par l'eau est celle perdue par le calorimètre.
Donc si je comprends bien, l'eau originale (froide) a gagnée 12°c (7.524 J de variation)
Donc le calorimètre a une variation de -7.524J ?
Pour moi,
L'eau a gagné de l'énergie calorifique, qui a été transféré du calorimètre vers l'eau. Cette chaleur transférée vaut Q_cal et puisque c'est la chaleur "transférée" ou "échangée", celle perdue par le calorimètre est - Q_cal.
(k est positive).
Bonsoir,
200 / 150 = 4/3
(33 - 21) / (42 - 33) = 12 / 9 = 4 / 3
Donc... vous trouvez K = 0 J.K-1
Mais supposez qu'il y ait une petite erreur dans la mesure de la température finale par exemple (liquide mal homogénéisé) et que cette température finale soit inférieure à 33 °C
alors on trouverait K 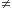 0 J.K-1
0 J.K-1
Ce n'est qu'une supposition...



