Inscription / Connexion Nouveau Sujet
Titrage du dioxyde de soufre dans le vin Blanc !
Je vous demanderai simplement si ce que j'ai écris est correcte ou non ?
Merci d'avance 
Voici l'énnoncé:
Le dioxyde de soufre est un gaz très soluble dans l'eau. Il joue le rôle de réducteur dans le couple oxydant/réducteur SO4²-(aq)/SO2(aq).
Pour éviter l'oxydation du vin, on ajoute du dioxyde de souffre au moût de raisin. La concentration massique en dioxyde de soufre est limitée à 210 mg.L-1 dans un vin blanc.
On peut vérifier la concentration de dioxyde de soufre dans ce vin, en dosant SO2(aq) par une solution titrante de diode de concentration C=7,8 10-3 mol L-1.
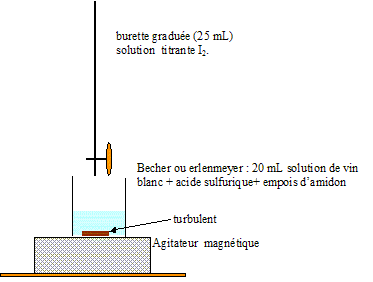
Dans un erlenmeyer, on verse un volume V=25,0 mL de vin blanc, 2 mL d'acide sulfurique afin d'acidifier ce milieu et 1 mL d'empois d'amidon. L'amidon a pour propriété de colorer en bleu la solution en présence de diiode.
L'équivalence est obtenue après avoir versé un volume Veq=6,10 mL de solution de diiode.
1)Dessiner et nommer la verrerie utile pour ce montage.
Réponse: voir l'image a la fin . merci 
2)Comment repére-t-on ici le volume éuivalent?
Réponse: L'équivalence est repérée par le changement de couleur de la solution dans le becher : avant l'équivalence, le diiode est en défaut ( solution incolore ); après l'équivalence le diiode est en excès. En présence d'empois d'amidon le diiode donne une teinte violet foncé.
3)Ecrire l'équation de la réaction chimique utilsée comme outil dans ce titrage.
Réponse:SO2(aq)+2H2O =SO4²-(aq)+ 4H+ +2e- : oxydation de SO2.
I2(aq)+2e- = 2I-(aq) : réduction diiode
I2(aq) + SO2(aq) +2H2O(l) = 2I-(aq)+SO4²-(aq)+4H+
4) Quelle est la quatité de matière de diiode n(I2)versé introduite a l'équivalence?
Réponse: Quantité de matière de diode n(l2) versé à l'équivalence : volume (mL) * concentration (mol/L) = Véq C = 6,10 10-3 * 7,80 10-3 = 4,758 10-5 mol
5)Etablire le tableau récapitulatif donnant l'évolution du sysème à l'équivalence. En déduire la quantité de matière de dioxyde de soufre dissoute dans la prise d'essai.
Réponse: à l'équivalence, d'après les coefficients stoéchiométriques de l'équation ci-dessus (Question 4) : n(I2)=n(SO2 )= 4,758 10-5 mol dans 25 mL de vin blanc
SO2(aq) + I2(aq) ajouté
initial v2 CSO2 0
en cours v2 CSO2-c1 v c1 v
équivalence v2 CSO2-véq * c1 =0 véq * c1 = 4,76 10-5 mol
Désolé c'est un petit tableau un peu rater 
6) Déterminerla concentration molaire, puis la concentration massique en SO2 du vin titré. Est-il conforme?
Réponse: Concentration molaire en SO2 de ce vin : qté de matière (mol) / volume de la prise (L) =4,76 10-5 /25 10-3 = 1,9 10-3 mol/L
Masse molaire SO2 : 32 + 2*16 = 64 g/mol.
Concentration massique en SO2 du vin : 1,9 10-3 *64 =0,1216 g/L = 122 mg/L, valeur inférieure à 210 mg/L.Donc la concertration massique est conforme.
7)La solution titrante de diiode est préparée de telle sorte que l'incertitude sur sa valeur soit de 5 10-5 mol/L. Sachant que le voume de la prise d'essai est mesuré à 0,06 mL près, déterminer l'incertitude relative sur la mesure de la concentration massique en SO2 du vin, en tenant compte de l'incertitude sur la valeur de Véquiv.
Réponse: Je l'avoue cette dernière question me fait bien des torts cela veux dire que je prend 1,9 10-3 mol/L et que je lui ajoute 5 10-5 mol/L? la je sais pas trop, mais après j'ajoute et je retire 0,06mL pour avoir l'incertitude, Je me trompe ouc'est ça ? 
Sinon merci de m'avoir lu et a la prochaine
Merci d'avance !

bonsoir!
et bravo pour la formulation de ton devoir! Quel travail de mise en page....
Tes questions 1 à 5 me semblent correctes.
question 6 : une idee....mais sans garantie du gouvernement ...
incertitude sur la concentration= 5.10-5 g/l
---> 7,8.10-3- 5.10-5< concentration < 7,8.10-3 + 5.10-5
incertitude sur le volume = 0,06 ml
---> 6,10-0,06 < volume < 6,10 + 0,06
la concentration molaire en SO2 = quantite de matiere / volume de la prise.
cette quantite de matiere est elle meme égale à Veq × concentration.
il y a donc ici un premier calcul d'incertitude à faire:
(6,10-0,06)×(7,8.10-3- 5.10-5) < Veq×C < (6,10 + 0,06)×(7,8.10-3 + 5.10-5)
puis tu recommences un autre calcul pour encadrer la concentration molaire en faisant attention de diviser à gauche par la plus grande valeur de la concentration et à droite par la plus petite valeur.
qu'en penses -tu?
As tu deja fait quelque chose comme ça en cours?
non, car on es un peu en retard dans le programme et notre professeur voudrai que l'on avance, et l'excercice qu'il nous demande de faire qui est celui la, est la pour nous insité a mieux étudié sur l'incertitude !
il est gentil mais s'il ne nous donne pas d'indice, on n'y arrivera jamais ,
merci de m'avoir aidée
et a la prochaine j'espère 
bonne chance et ne te bile pas trop...ce n'est qu'un exercice! 
Quand il le corrigera cela te permettra d'apprendre quelque chose à la fin!
Bonne soirée 



