Inscription / Connexion Nouveau Sujet
titrage conductimétrique du vinaigre
Bonsoir à tous,
Voici un exercice que je dois faire et je bloque sur certaines questions.
Le vinaigre est une solution aqueuse contenant de l'acide éthanoïque CH3COOH(aq).
Le degré d'acidité d'un vinaigre correspond à la masse d'acide éthanoïque contenue dans 100 g de vinaigre. Les vinaigres du commerce ont un degré d'acidité de l'ordre de 6°.
Manipulations : Le vinaigre, solution S de concentration C, est trop concentré. Avant de réaliser le titrage, on effectue une dilution par 10 du vinaigre commercial. On obtient une solution diluée S0, de concentration C0. On procède au titrage conductimétrique d'une prise d'essai de volume V0=10,0 mL de la solution S par une solution de soude de concentration CS=1,00.10-1 mol/L.
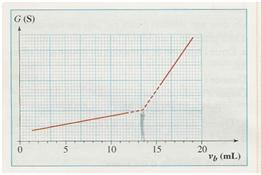
Résultats: Pour repérer l'équivalence, on mesure la conductivité de la solution titrée pour chaque volume VS de solution de soude ajouté. On trace alors le graphe  =f(VS).
=f(VS).
1. Réaction support du titrage
a. Donner le couple acido-basique auquel appartient l'acide éthanoïque, ainsi que sa demi-équation.
b. Quelle est l'espèce chimique titrante ? Donner le couple auquel elle appartient, ainsi que sa demi-équation.
c. Établir l'équation de la réaction support du titrage. Quelles propriétés doit-elle présenter ?
2. Titrage
Etat initial : Quelle devrait être la conductivité de la solution aqueuse de vinaigre avant le titrage ? Pourquoi n'est-ce pas le cas ?
Avant l'équivalence: Quel est le réactif limitant ?
Lister toutes les espèces chimiques participant à la conductivité de la solution présentes dans la solution titrante. Pour chacune d'entre elles, dire si sa quantité augmente, diminue ou est constante lors de l'ajout de la solution de soude.
Justifier l'allure du graphe avant l'équivalence.
Après l'équivalence : Quel est le réactif limitant ?
Lister toutes les espèces chimiques participant à la conductivité de la solution présentes dans la solution titrante. Pour chacune d'entre elles, dire si sa quantité augmente, diminue ou est constante lors de l'ajout de la solution de soude.
Justifier l'allure du graphe après l'équivalence.
Grâce à quelle espèce chimique la conductivité augmente-t-elle plus vite après l'équivalence ?
3. Exploitation
On détermine le volume équivalent sur le graphe : VS,Eq=10,7 mL.
a. Déterminer la concentration de la solution titrée S0.
b. Quel est le degré d'acidité du vinaigre S ?
c. Comparer cette valeur à celle donnée sur l'étiquette.
1. a. CH3COOH/CH3COO-
CH3COOH=CH3COO-+H+
b. espèce chimique titrante : la soude
couple : H2O/HO-
H2O=HO-+H+
c. CH3COOH+HO-  CH3COO-+H2O
CH3COO-+H2O
2. Etat initial : (?)
Avant l'équivalence :
Réactif limitant : la soude.
Espèces chimiques participant à la conductivité : les ions acétate CH3COO- et les ions hydroxyde HO-.
Les ions acétate augmentent et les ions hydroxyde diminuent lors de l'ajout de la soude.
L'augmentation de la conductivité est due à l'augmentation de la concentration des ions acétate.
Après l'équivalence :
Réactif limitant : le vinaigre.
Espèces chimiques participant à la conductivité : les ions acétate CH3COO- et les ions hydroxyde HO-.
Les ions acétate diminuent et les ions hydroxyde augmentent lors de l'ajout de la soude.
L'augmentation de la conductivité est due à l'ajout des ions hydroxyde qui ne réagissent plus avec le vinaigre. De plus, la conductivité molaire ionique des ions hydroxyde (19,92 mS.m².mol-1) est supérieure à celle des ions acétate (4,09).
La conductivité augmente plus vite après l'équivalence grâce aux ions hydroxyde.
3. a.
| équation | CH3COOH + | HO-  | CH3COO- + | H2O |
| état initial | n0 | nS | 0 | excès |
| état intermédiaire | n0-x | nS-x | x | excès |
| à l'équivalence | n0-xEq | nS-xEq | xEq | excès |
- à l'équivalence, tous les ions HO- sont consommés donc nS-xEq=0
 xEq=nS=CS*VS,Eq
xEq=nS=CS*VS,Eq
donc xEq=1,00.10-1*10,7.10-3=1,07.10-3 mol
- à l'équivalence, tous les ions CH3COOH sont consommés donc n0-xEq=0
 n0=xEq=1,07.10-3 mol
n0=xEq=1,07.10-3 mol
De plus, C0=n0/V0=(1,07.10-3)/(10,0.10-3) donc C0=1,07.10-1 mol/L.
Voilà il reste les deux dernières questions que je n'ai pas réussi.
J'aimerais également avoir une correction rapide si possible.
Merci d'avance et bonne soirée.