Inscription / Connexion Nouveau Sujet
tableaux d'avancement
Bonjour,
La conbustion incomplète de benzène, liquide de formule C6 H6, fournit du carbone et de l'eau.
1) Ecrire l'équation bilan. 2C6H6 + 3O2 donne 12C + 6H2O
2) Quelle est la masse de carbone obtenu en brulant 100 g de benzène?
masse (g) / masse molaire ( g/mol) = 100 /78 = 1028 mol de benzène.
12*1.28 = 15.36 mol de carbone.
masse molaire (g/mol) * quantité de matière ( mol) = 15.36 *12 = 184.32 g de carbone.
3) Quel volume d'air faudra t-il (CNTP)?
3*1.28 = 3.84 mol (s)
quantité de matière (mol) * volume d'air d'un gaz (L/mol) = 3.84 * 22.4= 86.0 L
L'air contient 20 % de O2 en volume 86*5 = 430 L d'air.
2C6H6 3O2 12C 6H2O
Etat initial x=0 (mol) 1.28 3.125 0 0
Etat intermédiaire x (mol) 1.28-2x 3.125-3x 12x 6x
Etat final x max (mol) = 0.64 1.28-2x max 3.125-3x max 12x max 6x max
= 0 = 1.205 =7.68 = 3.84
Est ce que mes résultats sont bons par avance merci.
Bonjour,
La combustion incomplète du benzène, liquide de formule C6H6, fournit du carbone et de l'eau.
Question 1 :
2C6H6 + 3O2 donne 12C + 6H2O
TB !
Question 2 : attention à la qualité rédactionnelle, ça pourrait te pénaliser le jour d'un examen :
=> Calcul des quantités de matières initiales en réactifs :
* ni(C6H6) = mi(C6H6)/M(C6H6) (indice "i" pour "initiale")
avec M(C6H6) = 6M(C) + 6M(H) = 6*12 + 6 = 78 g/mol
soit ni(C6H6) = 100/78 = 1,28 mol
Attention : ne pas utiliser l'écriture anglo-saxonne pour les décimales, on met des virgules en France !
* on suppose le dioxygène introduit en excès.
=> Tableau d'avancement de la réaction : OK
=> A l'état maximal, tout le benzène est supposé avoir réagi, sa quantité de matière est donc nulle : ni(C6H6) - 2xmax = 0 <=> xmax = ni(C6H6)/2 = 1,28/2 = 0,64 mol.
Donc il se forme nf(C) = 12xmax = 12*0,64 = 7,68 mol
soit une masse de carbone formée mf(C) = nf(C)*M(C) = 7,68*12 = 92,16 g
==> Grosse erreur d'inattention dans le calcul de ton avancement maximal : il ne faut pas oublier les coefficients stoechiométriques
 !
!
Question 3 à reprendre du coup, tu devrais trouver Vi(O2) = 215 L.

Tu t'es de nouveau planté(e) sur le calcul de l'avancement maximal de la réaction :
xmax = 0,64 mol et non 1,28 mol ...
C'est pourtant ce que tu as écrit dans ton tableau : faute d'inattention ?
Je m'inquiète un peu là 
Tu écris des choses sans en comprendre leur signification :
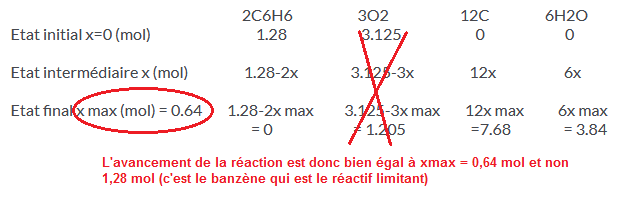
Tu t'es planté dans le calcul de la masse de carbone et dans le volume de dioxygène en supposant que xmax = 1,28 mol, ce qui est faux.

Déjà, as-tu compris le calcul de la masse de carbone formée ?
Ensuite, je ne comprends pas d'où tu sors ce "3,125 mol" (pas de ".", mais une ","), il n'est pas du tout mentionné dans l'exercice ...
On te demande de calculer la quantité de matière minimale nécessaire pour que le benzène soit le réactif limitant, ce qui revient à introduire les réactifs dans des proportions stoechiométiques :
ni(C6H6) - 2xmax = 0 <=> xmax = 1,28/2 = 0,64 mol
d'après ton tableau d'avancement de la réaction, il faut donc une quantité de matière minimale égale à ni(O2) = 3*xmax = 3*0,64 = 1,92 mol (logique puisqu'à l'état maximal, on veut que ni(O2) - 3xmax = 0 dans des proportions stoechiométriques).
or ni(O2) = Vi(O2)/Vm avec Vm le volume molaire
soit Vi(O2) = ni(O2)*Vm = 1,92*24 = 46,1 L de dioxygène nécessaires à la combustion de 100 g de benzène.
Or dans l'air il y a environ 20% de O2, donc le volume d'air total nécessaire est donc : V(air) = 46,1*5 = 230 L
Tu comprends ?
je ne comprends pas car plus haut vous trouvez 215 L et maintenant vous trouvez 230L.
Aprés je ne vois pas comment remplir la colonne où j'ai faut. Merci pour l'aide
En fait, tout dépend de la valeur du volume molaire choisie :
à 0°C : Vm = 22,4L/mol, alors V(O2) = 1,92*22,4 = 43 L, soit V(air) = 43*5 = 215 L.
à 20°C : Vm = 24 L/mol, alors V(O2) = 1,92*24 = 46 L, soir V(air) = 230 L.
Est-ce la valeur du volume molaire est précisée dans ton énoncé ?
Concernant ton tableau d'avancement pour O2 :
* état initial : ni(O2) = 1,92 mol
* état intermédiaire : ni(O2) - 3x
* état maximal : ni(O2) - 3xmax = 0
avec x max = 0,64 mol.
As-tu compris ton erreur sur le calcul de la masse de carbone ?
Celle du volume d'air minimal nécessaire ?
As-tu compris avec le lien la signification de "condition stoechiométrique" ?

dans mon énoncé , il y a on peut considérer q'une mole de gaz à un volume de 22,4 L (CNTP)
comment trouvé vous 1,92 mol en valeur initial
J'ai déjà répondu à cette question dans mon message du 19-11-17 à 12:54. Si tu ne suis pas le fil de l'échange, ça va devenir compliqué de t'aider  ...
...
Dans ce cas, si Vm = 22,4 L/mol, alors V(air) = 215 L, comme annoncé initialement.
Tu as de grosses lacunes sur les tableaux d'avancement d'une réaction, et sur l'interprétation des coefficients stoechiométriques de l'équation-bilan.
Commence par lire le lien que je t'ai passé (message du 19-11-17 à 13:12), tu comprendras mieux.
C'est complètement faux ... L'énoncé ne t'a jamais évoqué une masse de 100 g pour le dioxygène ...
D'ailleurs, pourquoi la question 2. te demanderai le volume d'air nécessaire pour brûler les 100 g de benzène si tu avais déjà le résultat ?
D'autre part, pour raisonner dans des proportions stoechiométriques, on ne doit jamais raisonner en masse, mais en quantité de matière.
Maintenant qu'on a fini cet exercice, j'aimerais savoir si tu as regardé le lien que je t'ai fourni.
1) 2C6H6 + 3O2 donne 12C + 6H2O
2) soit une masse de carbone formée mf(C) = nf(C)*M(C) = 7,68*12 = 92,16 g
3) à 0°C : Vm = 22,4L/mol, alors V(O2) = 1,92*22,4 = 43 L, soit V(air) = 43*5 = 215 L.
2C6H6 3O2 12C 6H2O
Etat initial x=0 (mol) 1.28 1.92 0 0
Etat intermédiaire x (mol) 1.28-2x 1.92-3x 12x 6x
Etat final x max (mol) = 0.64 1.28-2x max 1.92-3x max 12x max 6x max
= 0 = 0 =7.68 = 3.84
J'ai tout recopier est ce que c'est ça.
Je vais finir par l'écrire dans une autre langue : utilise l'écriture française pour les décimales : la virgule et non le point 
C'est ça, mais il faut que tu apprennes à mieux rédiger : inspire-toi de ce que j'ai fait.
As-tu regardé le lien ? Est-ce clair ou recopies-tu sans conviction ?

Pas de soucis, je préfère te le dire car ça pourrait irriter certains professeurs  .
.
Du coup ce lien ? C'est clair ?
OK, je t'en prie !
Garde le lien dans un coin de ton ordinateur, ça peut toujours resservir.
N'hésite pas à regarder des cours en ligne sur les tableaux d'avancement d'une réaction.
N'oublie pas enfin mes conseils sur :
* la qualité de rédaction d'un exercice scientifique ;
* l'utilisation de la virgule pour les décimales ;
* faire attention au nombre de chiffres significatifs fourni ;
* bien prendre le temps de lire l'énoncé (ne pas confondre la masse d'un premier réactif avec celle du second, etc.).



