Inscription / Connexion Nouveau Sujet
tableau davancement
bonjour
jai un enorme probleme avec le tableau davancement je comrpends vraiment pas pouvez vous mexpliquer en detail svp ce serait vraiment gentil car la je suis perdu
tous d'abord dans l'etat initial tu met le nombre de mole que ta calculer ou qui t'on deja donner (jespere que tu c'est calculer les quantité de matiere?)
ensuite dans l'etat intermediaire tu soustrait la mole par le nombre de mole que cette fois tu a dans la reaction
exemple: tu a cette equation
2C+6H--->4H2O (c'est qu'un exemple)
on te donne dans l'etat initial qu'il y a 6mole donc dans l'etat intermediaire tu aura 6-2x car il y a deux mole de carbonne dans l'equation et tu fait comme sa pour lasuite
esque je suis claire pour que je continue ?

oui c'est sa donc H si je te di qu'il y a 12 mole dans l'etat initial il y aura quoi alors dans l'etat intermediaire?
aten je compren pas dans ton post davant tu ma dis:
ensuite dans l'etat intermediaire tu soustrait la mole par le nombre de mole que cette fois tu a dans la reaction
commen ca la mole par la mole de la reaction je compren pas la cele que jai trouver avant la cest quoi alor ?
dans un enoncer on te donne un nombre de mole et dans la reaction il y a des mole tu comprend mieux
2C+6H--->4H2O
honetement je suis perdu la
peux tu me faire le tableau complet de cette equation pour que je comprene mieu et moi jessaye de te faire la suivante tu ve bien ?
oui mais je peu pas faire le tableau dsl si je peux pas t'aider plus je c'est pas comment te le respliquer
Salut!
Je vais faire un essai...
La réaction chimique et son équation:
I) La réaction chimique:
La réaction chimique modélise la transformation chimique subie par un système.
II) L'équation (ou équation-bilan) d'une réaction:
1) L'équation d'une réaction est l'écriture symbolique d'une réaction chimique. Elle comporte:
Une flèche qui indique le sens de la transformation,
A gauche de la flèche, les symboles des réactifs séparés par des signes +,
A droite de la flèche, les symboles des produits de la transformation séparés par des signes +.
Des nombres stoechiométriques, placés devant chaque symbole, choisis de telle façon que la loi de conservation des éléments soit satisfaite. On dit qu'on ajuste les nombres stoechiométriques.
2) Remarques:
Le nombre stoechiométrique 1 n'est jamais écrit.
Si la transformation met en jeu des ions, l'ajustement des nombres stoechiométriques doit aussi réaliser la conservation de la charge électrique.
3) Exemple:
H2 + 1/2O2 ---> H2O ou 2H2 + O2 ---> 2H2O.
CuCl2 ---> Cu2+ + 2Cl-
4) Équation et quantité de matière:
Les nombres stoechiométriques indiquent dans quelles proportions les quantités de matières des réactifs réagissent et ce quelques soient les quantités de matières des réactifs mis en présence. Par exemple l'équation de la réaction de formation de l'eau donnée en 3 indique que:
Si x mol de O2 disparaissent alors 2x mol de H2 disparaissent aussi et il se forme 2x mol de H2O.
Avancement et bilan de matière:
Avancement de la réaction:
En reprenant l'exemple précédent, x est appelé avancement de la réaction à la date t. Ce nombre permet de suivre l'évolution de la transformation et donc de caractériser le système à un moment donné.
L'avancement maximal xmax s'obtient en écrivant que les quantités de matières des réactifs sont toujours positives ou nulles.
On suppose en seconde et en première qu'une réaction s'arrête lorsqu'un des réactifs a été totalement consommé. Ce réactif est appelé réactif limitant. Il est tel que sa quantité de matière est nulle (il n'en reste plus) lorsque x = xmax, c'est-à-dire lorsque l'avancement est maximal.
Dans certains cas tous les réactifs sont totalement consommés. On dit alors qu'ils ont été introduits dans les proportions stoechiométriques.
Bilan de matière.
Rappelons que les quantités de matières peuvent être déterminées à partir des masses ou des volumes (plus particulièrement pour les gaz) en utilisant les relations suivantes déjà rencontrées:
et
Supposons que l'on réalise une réaction chimique en mettant en présence 0,2 mol de dioxygène et 0,2 mol de dihydrogène. Dressons un bilan complet de matière.
Ce bilan est, en général, présenté sous forme de tableau que l'on construit progressivement.
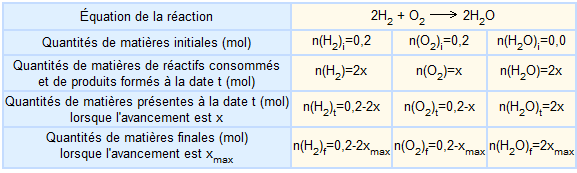
A ce stade de l'étude, le tableau n'est pas complet car xmax n'est pas connu et reste à déterminer. Il est possible de déterminer xmax de deux manières différentes:
1) Méthode des quantités de matières toujours positives ou nulles.
n(H2)t = 0,2 - 2x 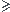 0 => 2x
0 => 2x 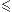 0,2 => x
0,2 => x 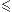 0,1
0,1
n(O2)t = 0,2 - x => x 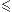 0,2
0,2
Les deux dernières inégalités sur x sont satisfaites pour x 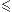 0,1. On retiendra donc la valeur xmax = 0,1 mol. Il devient alors possible de compléter la dernière ligne du tableau précédent.
0,1. On retiendra donc la valeur xmax = 0,1 mol. Il devient alors possible de compléter la dernière ligne du tableau précédent.

Le dihydrogène est totalement consommé il apparaît comme le réactif limitant.


 Commene par méditer ceci
Commene par méditer ceci
