Inscription / Connexion Nouveau Sujet
Tableau d'avancement ( déterminer des quantités en mol )
Bonjour à tous voilà malgré l'heure tardive je vous écris pour vous demandez un peu d'aide sur l'exercice suivant :
L'aluminium réagit avec le dichlore pour donner du chlorure d'aluminium AlCl3.
On dispose de 12L de diclhore et de 27g d'aluminium.
Dans les conditions de l'expérience, le volume molaire est Vm = 24L.mol-1
1 ) Ecrire l'équation chimique de cette transformation.
Cette question je l'ai faite voici ce que j'ai trouvé : 2Al + 3Cl2 ---> 2AlCl3
2 ) Déterminer en mol les quantités de dichlore et d'alumnium dont on dispose.
Voilà c'est cette question sur laquelle je bloque.... Si vous pouviez m'aider car elle débloque la question 3 et 4 que je n'aurais aucun mal à faire ( dont le tableau d'avancement ) 
Merci de votre aide 
Bonjour Clem75013,
L'équation chimique de la transformation que tu as proposée est juste !
Passons aux quantités de matière :
* Il y a une masse m(Al)=27 g d'aluminium. Or, tu connais sa masse molaire M(Al)=27 g/mol.
Sa quantité de matière est donc égale à : n(Al)=m(Al)/M(Al)=1,0 mol.
* Ensuite, il y a un volume V(Cl2)=12 L de dichlore. Or le volume molaire est Vm=24 L/mol.
Sa quantité de matière est donc égale à : n(Cl2)=V(Cl2)/Vm=0,50 mol.
As-tu compris ? (Ces formules doivent avoir été données et expliquées en cours non ?)
masterrr 
Oui évidemment c'est moi qui suis aller trop vite je n'ai pas pris le temps de m'arrêter sur les formules car vu l'heure qu'il était ^^ Mais en effet cela me paraît tout simple maintenant, merci ) toi masterrr 
J'aurais une autre petite question pour toi encore une fois pour remplir un autre tableau :dont voici les données : M(C) = 12g.mol-1 M(H) = 1g.mol-1
M(O) = 16g.mol-1 M(Pb) = 207g.mol-1
M(N) = 14g.mol-1 M(Fe) = 56g.mol-1
J'ai calculé ce que je savais faire mais ensuite je ne vois pas comment et par quel rapport entre les formules on peut trouver les résultats manquant ??
Voilà le lien en plus lisible peut être, je suis désolé mais je n'ai pas trouvé de commande pour éditer mon message donc je post à la suite 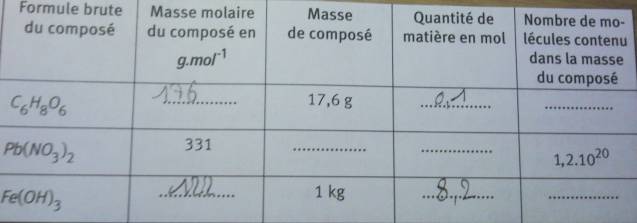
* T_P : image recadrée, retaillée, placée sur l' , merci de consulter la FAQ pour savoir comment correctement attacher une image sur le forum STP *
, merci de consulter la FAQ pour savoir comment correctement attacher une image sur le forum STP *
Mais de rien ! 
Tu ne peux pas éditer ton message... C'est réservé aux correcteurs/modérateurs.
Pour les notations, j'utilise n(X)/m(X)/M(X)/N(X) pour la quantité de matière/masse/masse molaire/nombre d'entités du composé X.
Donc :
* n(C6H8O6)=m(C6H8O6)/M(C6H8O6)=0,10 mol (attention aux chiffres significatifs...) et N(C6H8O6)=n(C6H8O6)NA=6,02.1022 entités où NA=6,022.1023 est la constante d'Avogadro ;
* pour la suite tu dois savoir te débrouiller avec les formules usuelles : n=m/M=N/NA en faisant attention aux unités des données du tableau et aux chiffres significatifs.
Bon courage ! 
Si tu as d'autres questions, n'hésite pas.


