Inscription / Connexion Nouveau Sujet
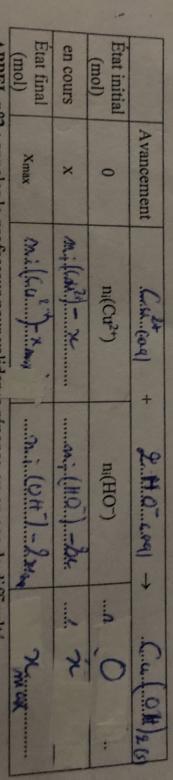
Tableau d avancement
Bonsoir tout le monde
En fait j ai un exo que j arrive pas à faire:
On fait reagir une solution aqueuse de sulfate de cuivre 2 et de la soude , c'est à dire de l'hydroxyde de sodium solode .
1-Et ils nous ont demandé l equation chimique et le tableau d avancement .(c est fait)
2-sachant que c(sulfate de cuivre 2)=0.15mol/L et si l on suppose que le volume mesuré est 50cm3, determiner ni(Cu2+) . ( j'ai trouvé 7,5 on applicant n=c*V )
3- en deduire xmax lorsque les proportions des réactifs sont stchiométrique, puis en deduire ni(HO-). (Ça aussi j ai trouvé puisqu'ils sont stchiométriques donc ni(Cu2+)=ni(HO-)=7,5mol).
4-sachant que la dilution de la soude dans l'eau se fait suivant l equation:
NaOH Na+ +HO- , quelle est la quantité de matière initiale de soude n(NaOH) dans ce cas?je n'est pas su faire
Na+ +HO- , quelle est la quantité de matière initiale de soude n(NaOH) dans ce cas?je n'est pas su faire
Bonsoir,
Attention !
ni(Cu2+) = C* V = 0,15 * 50.10-3 = 7,5.10-3 mol
La concentration étant exprimée en moles par litre, le volume doit être exprimé en litre.
1 cm³ = 1.10-3 L
Question 4 :
L'équation de dissolution de la soude montre que la quantité initiale de soude
est égale à la quantité obtenue de HO-
Ah ok d'accord
At apres ils nous en demandé de calvuler la masse ( je l ai fait )
Et dans la dernière question
Comment peut in verifier catte valeur à partir su nombre de pastilles correspondant auc proportions stchiométriques ?
40g c'est la masse d'une mole de NaOH
Ici, la quantité de matière de soude n'est pas de 1 mole mais de 7,5.10-3 mol
Je te laisse rectifier.
(Ça aussi j ai trouvé puisqu'ils sont stchiométriques donc ni(Cu2+)=ni(HO-)=7,5mol).
Non.
La réaction est : Cu2+ + 2HO-
 Cu(OH)2
Cu(OH)2
Dans les proportions stchiométriques on a :
ni(HO-) = 2 * ni(Cu2+) = 2*7,5*10-3 = 0,015 mol
Il en résulte à la question 4 que ni(NaOH) = n(HO-) = 0,015 mol
Bonsoir excusez moi mais quand j ai fait mon calcule j ai teouvé m = 600x10-3 ce qui n'egale pas à ce que j ai trouvé avant car dans la consigne ils nous ont demandé de verifier la valeur precedente mais d une autre maniere fin c'est ce que j ai compris si c'est faux expliquez mois s il vous plait
Je ne sais pas ce que tu désignes par " m " . J'imagine sans certitude qu'il s'agit de la masse de soude.
Je ne sais pas non plus si m =600.10-3 tonnes ou 600.10-3mg ou tout autre chose. Un résultat donné sans unité n'a strictement aucun sens.
Je ne sais pas ce que "tu as trouvé avant" ni ce qu'est la "valeur précédente" . La première chose à faire si on veut être aidé est de poster l'énoncé, tout l'énoncé, sans rien oublier et sans rien y changer.
Ah d'accord
Suite enoncé:
5- calculer la masse de NaOH
6- comment peut on vérifier cette valeur (massa) à partir du nombre de pastilles correspondant aux proportions stchiométriques?
Voilà
Question 5:
Masse molaire de NaOH : M(NaOH) = 23 + 16 + 1 = 40g/mol
Quantité de matière de NaOH : n(NaOH) = 0,015 mol
masse de NaOH : m(NaOH) = 0,015 * 40 = 0,60g
Question 6:
Une fois encore, il manque des éléments pour pouvoir répondre.
Que signifie " massa " ?
De quelles pastilles est-il question ? Que sait-on à leur sujet ?
6-je voulais dire la masse * et pour les pastilles de soude car le soude ce sont des petites graine blache en fait elles ont la forme d'une graine qu'on dissoud dans l'eau
Si l'énoncé ne dit rien de plus sur ces pastilles de soude, en particulier s'il ne donne pas la masse approximative moyenne de l'une de ces pastilles je ne vois pas comment on peut répondre à cette question.
Est ce que je peux le prendre en photo vous le montrez
Non.
Le règlement de ce site est formel :
Les images postées ne doivent pas contenir de texte.
Tout enoncé
L'objectif est de vérifier le masse de soude nécessaire pour que les proportions soient stchiométriques, c est à dire qu'il n'y ait plus de réactifs restant dans l etat finale.
1-le produit obtenu est un précipité appelé hydroxyde de cuivre de formule Cu(OH)2 .
Ecrire l'equation Chimique de la réaction et l équilibrer.
2-complèter le tableau d'avancement sans valeurs numériques: