Inscription / Connexion Nouveau Sujet
Synthèse de la lidocaïne
Bonjour je voudrais savoir si mes réponses sont bonnes 
Exercice 1:
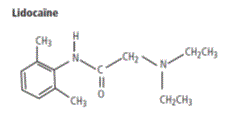
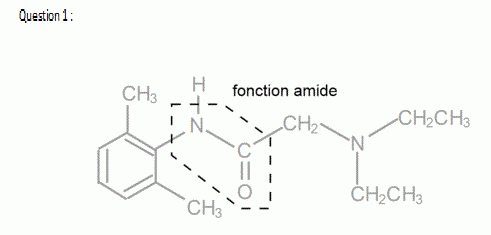
1) La lidocaïne est un amide. Recopier sa formule et entourer le groupe caractéristique amide.
2) Choisir dans la liste suivante la verrerie que l’on doit utiliser pour mesurer les volumes V2 et V3.
Justifier.
- bécher 50 mL - fiole jaugée 50 mL - pipette jaugée 10 mL
- bécher 100 mL - éprouvette graduée 10 mL - éprouvette graduée 50 mL
3) Montage
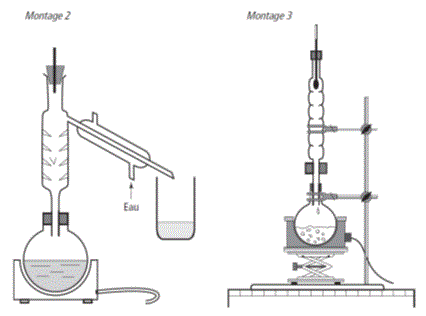
a) Indiquer parmi les montages suivants celui qui représente un chauffage à reflux.
b) Quel est l’intérêt de ce type de montage ?
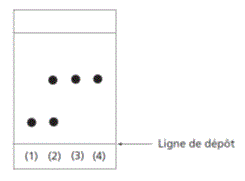
4) D’après le chromatogramme (page précédente), à partir de quelle date peut-on considérer avec certitude que la réaction est terminée ? Justifier.
5) Pendant la deuxième étape de l’extraction, quelle gamme de température choisir afin d’évaporer la totalité du pentane et cristalliser la lidocaïne ?
6) Déterminer la quantité de matière initiale du réactif A.
------------------------------------------------------------------------------
Voilà ce que j'ai fais 
1) Je l'ai attachée à la fin
2) V2 = 10 mL ; comme c'est le volume d'un des réactifs il doit être mesuré avec le plus de précision possible, on choisit donc la pipette jaugée de 10 mL.
V3 = 50 mL ; c'est le volume de solvant, la mesure ne nécessite pas une grande précision, on choisit donc l'éprouvette graduée de 50 mL.
3)a) Le chauffage à reflux est le montage n° 3.
b)
Lors du chauffage à reflux les vapeurs sont condensées dans le réfrigérant à boules et le liquide redescend dans le ballon. Ce système permet de chauffer le milieu réactionnel, et donc d'augmenter la vitesse de réaction, sans perdre de réactifs ni de produits par vaporisation.
4) Le chromatogramme fait apparaître deux substances distinctes, l'une présente dès le premier prélèvement (il s'agit donc de A) et l'autre qui apparaît au deuxième prélèvement (il s'agit donc de la lidocaïne). Au troisième prélèvement, on constate la disparition de A, qui a été totalement consommé : la réaction est donc déjà terminée au bout de 60 min.
5) La température d'ébullition du pentane est de 36 °C.
La température de fusion de la lidocaïne est de 68 °C.
Il faut donc se placer entre 36 °C et 68 °C pour vaporiser le pentane sans faire fondre la lidocaïne.
6) nA = mA / MA
nA = 4,0 / 197,7 = 2.10-2 mol
La quantité de matière initiale du réactif A est donc : 2.10-2 mol
Merci pour votre aide 


** énoncé effacé ; images laissées **
Edit Coll : si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum 
![]()
Merci beaucoup pour votre aide 
En faite je vais aussi poster un autre exercice qui fait partie du même devoir, car mon devoir comporte 2 exercices dans la parie physique et 2 exercices dans la partie chimie et puisque c'est mon dernier devoir à faire j'aimerai bien avoir une bonne note 
Merci encore pour votre aide 
c'est ce topic : ![]() La molécule de saccharose ?
La molécule de saccharose ?
Si c'est le cas tu as déjà de l'aide, et molecule10 repassera probablement
Oui c'est ça 
Mais je n'arrive pas vraiment à comprendre si la dernière réponse est juste, pouvez-vous le voir svp?
désolée mais je n'ai pas pour habitude de répondre à un topic dont quelqu'un s'occupe déjà  Ne t'inquiète pas il va repasser
Ne t'inquiète pas il va repasser
Bonjour shadowmiko 
Je veux bien envoyer mon devoir aujourd'hui mais jusqu'à maintenant je n'ai pas reçu un message sur le sujet "la molécule du saccharose" pouvez-vous le voir svp?
Merci beaucoup 


