Inscription / Connexion Nouveau Sujet
Synthèse de l'ammoniac
Voici un exercice dont je ne vois pas le bout, une personne gentille, avec des explications claires, et beaucoup de patience pourrait elle m'aider ? Et voir avec moi si les réponses que j'ai trouvé sont justes ou totalement à coté de la plaque.
Énoncé :
Pour réaliser le synthèse de l'ammoniac gazeux ( NH3), il faut faire réagir du dihydrogène et du diazote.
Les volumes de gaz introduits sont V(H2)=130 L et V(N2)=50.0 L dans les conditions où le volume molaire gazeux est Vm=24.0 L/mol.
1. Écrire l'équation chimique de cette réaction
2. Déterminer la quantité de matière initiale de chaque réactifs
3. Quel est celui présent en plus grande quantité
4. Déterminer l'avancement maximal
5. Quel est le réactif limitant ?
6. Pourquoi le réactif présent en plus grande quantité peut être aussi le réactif limitant ?
7. Déterminer la quantité des espèces présentes en fin de transformation
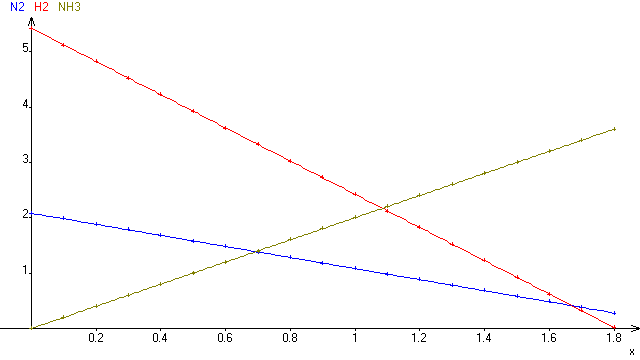
8. Tracer sur un même graphique les quantités de toutes les espèces en fonction de l'avancement x.
9. Pour réaliser une solution ammoniaquée, on dissout le gaz ammoniac obtenu dans 1m3 d'eau. On rappelle 1dm3=1L.
a) Quelle est la concentration molaire de la solution ?
b) Quelle est, pour cette solution la concentration massique ammoniac ? M(NH3)= 17g/mol
Voili voilou, merci bcp d'avance, à la personne qui aura la patience de m'aider.
Bonjour,
Est-ce que tu pourrais préciser quelles sont les questions que tu as réussies, lesquelles te posent problème et ce que tu as comme idées pour savoir où t'aider?
Alors j'ai répondu à la question 1 jusqu'à la question 5
Sachant que je ne suis pas sur de mes résultats.
J'ai une idée pour la question 6 mais je sais pas trop comment la formuler
ALors,
1. N2+3H2-->2NH3
2. Je trouve n (H2)=5.42 mol
n (N2)=2.08 mol
3. H2 est présent en plus grande quantité
4.J'ai fait un tableau d'avancement mais je trouve des trucs qui me paraisse bizar car je trouve pas un résultat précis
5. le réactif limitant est le Dihydrogène
C'est bien ça pour les 3 premières questions.
Qu'est-ce qui te pose problème dans la question 4? Vu que tu as trouvé que H2 était le réactif limitant, je suppose que tu as trouvé l'avancement maximal.
si x est l'avancement maximal, on a x = 2,08 mol ou x=5,42/3 = 1,81 mol
comme 1,81 2,08 , x = 1,81 mol et le réactif limitant est le dihydrogène
2,08 , x = 1,81 mol et le réactif limitant est le dihydrogène
 Aie confiance en toi!
Aie confiance en toi!
Pour la question 6, qu'est-ce que tu en penses?
Pour la 7, il suffit de remplacer le x de ton tableau d'vancement par 1,81 mol
Pour la 8, je ne peux pas trop t'aider vu que c'est un graphique
Bah pour la 6 je sais pas comment m'expliquer =S
Je pense à quelque chose du genre, comme il faut 3 fois plus de H que de N pour le synthèse de l'ammoniac, le réactif limitant et donc aussi le réactif en plus grand quantité
Oui, c'est pas mal, j'aurais dit un truc du genre: dans l'équation de la réaction le coefficient stoechiométrique de H2 est 3 fois plus grand que celui de N2, donc on consomme 3 fois plus de H2 que de N2 pour chaque molécule de NH3 formée. Ce qui explique que malgré que le dihydrogène soit en plus grande quantité, c'est celui qui est entièrement consommé en premier (qui est le réactif limitant). Après ce n'est qu'une formulation parmi d'autres (sans doute pas la meilleure), dis le avec tes mots et ce sera bien. (par contre parle bien de dihydrogène et de diazote, parce que le N et le H tout seul dans la nature ça court pas les rues  )
)
D'accord ça marche, merci beaucoup =D
Et pour le graphique je vois pas ce que je dois représenter dessus
Et bien tu mets l'avancement x en abscisse, et en ordonnées les quantités de matière des réactifs.
Tu choisis différentes valeurs de x (inférieures ou égales à l'avancement maximal), tu calcules pour chaque valeur la quantité de N2, de H2, de NH3 et tu reportes sur ton graphique
(je l'ai fait par ordinateur, ça va plus vite, mais ce n'est pas la peine de prendre autant de points!)