Inscription / Connexion Nouveau Sujet
Structure des Molécules
Bonjour tout le monde!
Voilà l'exercice: Les molécules contenant l'élément soufre sont très souvent caractérisées par une odeur désagréable. C'est le cas du gaz émis par les moufette.
1) Donner la formule brute de la molécule.
2) Déterminer sa structure de Lewis.
3) A partir des numéros atomiques des atomes, dénombrer les doublets liants et non liants des atomes de carbone et de soufre. Carbone.Z=6, soufre.Z=16.
4)Justifier la structure géométrique de la molécule à partir de la répartition des doublets autour des atomes de carbone et des atomes.
J'ai trouvé que pour le 1) c'est C2 H6 et S2
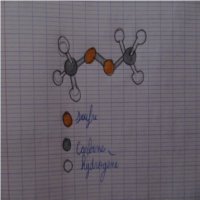
le 2) La représentation de Lewis et le 3) Le carbone a quatre doublets liants et le Soufre a deux doublets liants et deux non liants.
Mais je ne comprend pas la 4), par rapport à sa représentation de Lewis je ne sais pas quelle structure elle est !! Elle ne ressemble pas à une plate, ni une tétraédrique..
Merci d'avance de votre aide.

Non, le chapitre sur la structure des molécules est récent on vient juste de voir en cours les formules de Cram et de Lewis et les stéréoisomères!
Sur internet, ils disent grosso modo qu'à partir de la formule de Lewis on compte le nombre de doublet liant et que 2 font une molécule linéaire, 3 une trigonale plane et 4 une tétraédrique!
Enfait il faut décomposé la molécule de soufre, d'un coté il y a le carbone avec ces 4 doublets liants du coup c'est une figure tétraédrique et de l'autre le soufre qui en a 3 est qui font une figure plane! C'est bien ça ?
Les doublets liants ou non, correspondent à des paires d'électrons.
Comme les électrons sont chargés négativement, les doublets électroniques se repoussent mutuellement, conformément à la loi de Coulomb ; les doublets vont donc se placer autour de chacun des atomes de la molécule de façon à être aussi éloignés que possible les uns des autres.
Pour chacun des atomes de carbone, les 4 doublets liants se placent, comme vous le dites, de façon tétraédrique.
3 des sommets du tétraèdre sont occupés par des atomes H, le quatrième par un atome S ; l'atome C occupant, évidemment le centre du tétraèdre.
Pour chacun des atomes de soufre, les 4 doublets, 2 liants et 2 non liants, se placent là aussi de manière tétraédrique.
L'atome S considéré étant au centre du tétraèdre, 2 des sommets du tétraèdre sont vides, ils correspondent aux 2 doublets non liants.
Les 2 autres sommets de ce tétraèdre sont occupés par les atomes voisins de l'atome S considéré, c à d, l'autre atome S et l'un des atomes C ; les liaisons C-S-S, forment donc un angle .
Le premier des dessins que vous avez joints à votre premier message montre assez bien la disposition des atomes les uns par rapport aux autres.
En suivant le lien ci-dessous, vous pourrez voir un schéma du modèle moléculaire correspondant au composé étudié : H3C-S-S-CH3 
![]() (cliquez sur la maison).
(cliquez sur la maison).
A plus.


