Inscription / Connexion Nouveau Sujet
Spectres Atomiques
Bonjour,
Je rencontre un petit problème face à une question de mon DM d'Astrophysique ...
1ere loi : un gaz à pression élevée, un solide ou un liquide, s'ils sont chauffés, émettent un rayonnement continu qui contient toutes les couleurs.
2eme loi : Un gaz chaud, à basse pression, émet un rayonnement uniquement pour certaines couleurs bien spécifiques : le spectre de ce gaz présente ds raies d'émission.
3ème loi : Un gaz froid, à basse pression absorbe certaines couleurs produisant ainsi dans le spectre ds raies d'absorption. Ce gaz absorbe les mêmes couleurs qu'il émettrait s'il était chaud. Pour détecter ce spectre l'observateur doit se situer de l'autre côté du gaz par rapport à la source de rayonnement continu qui lui donne naissance.
1. Pour chacune de ces trois lois, qualifier le spectre auquel il est fait référence.
Dois-je simplement dire si c'est un spectre de raies d'émission ou d'absorption ?
Bonne Soirée,
Merci !

1) "spectre continu" ou spectre du corps noir ou spectre thermalisé
2) oui, "spectre d'émission"
3) oui, "spectre d'absorption"

Merci !
Ensuite, on me demande :
Tracer la transition électronique T1 correspondant à la raie H de la série Balmer sur le schéma ci-dessous.
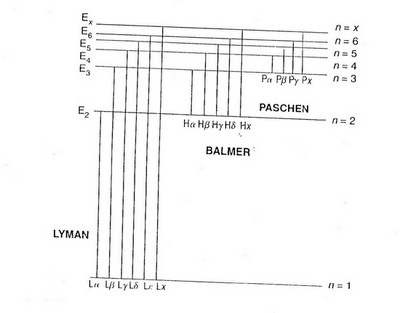
Je ne crois pas qu'il s'agisse d'une raie H/lambda
Peut-être s'agit-il de la raie H ("H alpha")
("H alpha")
Tu as accès, grâce au bouton  ("Pi majuscule") qui se trouve dans la barres des boutons,
("Pi majuscule") qui se trouve dans la barres des boutons,
sous le cadre d'écriture 
à de nombreux symboles et en particulier à beaucoup de lettres de l'alphabet grec.
Peux-tu corriger ?

Si je comprends bien, on te demande simplement de tracer une flèche dont l'origine et l'extrémité sont les niveaux de départ et d'arrivée de l'électron quand il cède une énergie qui permet l'émission d'un photon de la raie H .
.

Je vous poste l'énoncé complet pour plus de clareté :
On rappelle que l'énergie d'un niveau n de l'atome d'hydrogène est donnée par la relation En = E1/n^2.
L'énergie du niveau fondamental d'un atome d'hydrogène est E1 = -13.6 eV. La lumière émise par certaines nébuleuses contenant beaucoup d'hydrogène gazeux chauffé mais à basse pression, est due à la transition électronique entre les niveaux d'énergie n=2 et n=3 correspondant à la raie H de la série Balmer.
1. Sur le document ci-après, indiquer une flèche que l'on désignera par T1, cette transition électronique.
Je dois donc tracer une flèche en haut de la raie H ?
?
2. Déterminer littéralement puis numériquement la longueur d'onde dans le vide ainsi émise.
Je fais E =
 ?
?
3. A l'aide des données, indiquer la couleur d'une telle nébuleuse pour un observateur terrestre.
J'en déduis que ceci sera le résultat du calcul précédent ?
Encore Merci pour votre précieuse aide.
Voilà... mais pourquoi n'as-tu pas posté l'énoncé dans le premier message du topic ? ?
Il faut tracer une flèche qui part du niveau n = 3 et qui arrive au niveau n = 2
Quand un électron passe du niveau n = 3 au niveau n = 2 il doit perdre de l'énergie. Il la communique à un photon qui sera perçu comme appartenant à la raie H
Question 2
Que vaut l'énergie de ce photon ? Et donc que vaut sa fréquence ? Et donc quelle sera sa longueur d'onde dans le vide ?

Pour la question 2 :
Puisque En = E1/n^2
 E = Ep - Em
E = Ep - Em
a-n :  E = (-13.6/3^2) - (13.6/2^2)
E = (-13.6/3^2) - (13.6/2^2) 1.88 eV.
1.88 eV.
On convertit cette valeur en Joules :
1.88 x 1,60.10^-19 = 3,008 x 10^-19 J.
E = h. c/ = h.
= h.
a-n : E = 6,63.10^-34 x (3,00.10^8/3.008.10^-19) = 6,61 x 10^-7 m = 661 nm.
Sa longueur d'onde dans le vide sera de 661 nm. Cette radiation n'est pas visible à l'œil nu et fait parti du domaine des Infrarouges.
C'est bien cela ?
 E
E  1,89 eV ou 3,026.10-19 J
1,89 eV ou 3,026.10-19 J
 = h.c/
= h.c/ E
E

 6,6262.10-34
6,6262.10-34  299 792 458 /3,026.10-19
299 792 458 /3,026.10-19  6,56.10-7 m ou 656 nm
6,56.10-7 m ou 656 nm
Ce qui correspond à la longueur d'onde dans le vide d'un joli rouge (pas encore les infrarouges).

Oui, au moins pour cette raie et à la condition que la vitesse radiale de la nébuleuse par rapport à la Terre soit nulle ou très faible.



 (vertes) des raies H
(vertes) des raies H (bleues) des raies H
(bleues) des raies H
