Inscription / Connexion Nouveau Sujet
Solutions électrolytiques
Bonjour, notre prof nous a donné un exercice. J'aimerais avoir de l'aide.
Merci d'avance.
L'acide nitrique HNO3 est un liqude moléculaire à caractere dipolaire; cette dissolution dans l'eau libère des ions oxonium et des ions nitrate.
a-écrire l'équation de la dissolution de l'acide nitrique dans l'eau.
b-sur un flacon d'acide nitrique, on releve les informations suivantes:
acide nitrique: 68%; d=1.41. M= 63.0g/mol
Calculer la concentration molaire de la solution contenue dans le flacon.
c-Quel volume Vo de cette solution doit on prélever pour préparer 500mL de solution tel que:
[NO3-(aq)]=0.10 mol/L?
merci d'avance
Salut !
!
a) HNO3(l) ---> H3O+ + NO3-(aq)
b) La densité est la masse d'un litre de solution donc mthéorique = 1,41 kg
Or, cette solution n'est pûre qu'à 68% donc mréelle = (68/100)*1,41 = ... kg.
n = m/M (convertis m en grammes) puis c = n/V
c) Principe d'une dilution: la quantité de matière se conserve donc n0 = n
C0V0 = CV
V en litres...
Tu parles des "H" je suppose?
A la base c'est HNO3 ---> H+ + NO3-.
Mais comme dans l'eau, H+ ne reste pas sous cette forme, tu as l'équation que je t'ai donnée
A ce moment là tu ne tiens pas compte des atomes...
ce que je n'ai pas compris c que pour NaCl dans l'eau par exemple,
l'équation sera NaCl (s).....> Na+ (aq)+ Cl- (aq)
pour cette é&quation pourtant on ne rajoute pas d H2O comme pour HNO3
merci d'avance et à demain.
jer crois que c que quand il y a des H, non?
d'habitude on ne raojute jamais d H2O ds les produits. Explique moi stp j ai un petit controle demain merci
Un solide ionique est formé d'ions (cations et anions) régulièrement disposés dans l'espace et formant une structure solide appelée cristal.
La cohésion (solidité) du cristal est assurée par les interactions électriques entre tous les ions.
Un solide ionique est électriquement neutre, c'est-à-dire qu'il contient autant de charges positives apportées par les cations que de charges négatives apportées par les anions. On attribue au solide ionique une formule statistique qui traduit cette neutralité électrique.
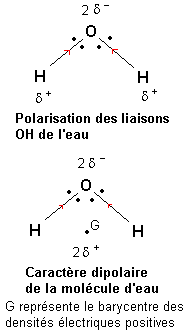
L'électronégativité d'un élément est la tendance d'un atome de cet élément à attirer le doublet d'une liaison covalente dans laquelle il est engagé.
D'une façon générale, l'électronégativité des éléments augmente lorsqu'on se déplace de gauche à droite dans une période (ligne) du tableau périodique des éléments. L'électronégativité des éléments augmente lorsqu'on se déplace de bas en haut dans une famille (colonne) du tableau périodique des éléments.
L'électronégativité de l'oxygène est plus forte que celle de l'hydrogène. Une étude du déplacement des doublets de liaison semblable à celle conduite dans le paragraphe précédent montre que les liaisons O—H de la molécule d'eau sont polarisées de telle façon que l'oxygène porte une densité électrique négative (2 -) et que chaque hydrogène porte une densité électrique positive (
-) et que chaque hydrogène porte une densité électrique positive ( +).
+).
Le barycentre des densités électriques positives se situe au milieu du segment joignant les deux atomes d'hydrogène. Il apparaît alors qu'étant donnée la forme de la molécule d'eau, les barycentres des densités électriques positives et négatives sont distincts. La molécule d'eau présente un caractère polaire (on dit dipolaire si il y a deux pôles).
Ce caractère dipolaire de la molécule d'eau lui confère des propriétés de solvant très particulier (ce n'est pas le seul solvant dans ce cas).
L'eau a pour propriété de détruire les solides ioniques et de disperser les ions. Ces phénomènes s'accompagnent du phénomène de solvatation des ions. Cette solvatation est due au caractère dipolaire de l'eau.
Les cations en solution attirent (interaction électrique) les molécules d'eau par leur partie négative. Il en résulte que chaque cation s'entoure d'un certain nombre de molécules d'eau.
Les anions en solution attirent les molécules d'eau par leur partie positive. Il en résulte que chaque anion s'entoure d'un certain nombre de molécules d'eau.
Ce phénomène est appelé solvatation des ions. Lorsque le solvant est l'eau la solvatation est appelée hydratation.
Le proton H+ s'associe par une véritable liaison à une molécule d'eau pour former l'ion oxonium H3O+.
(Tu verras ce phénomène plus tard avec les réactions acido-basiques, en cours d'année de première):
H+ + H2O = H3O+.
Cet ion oxonium est lui-même solvaté ou hydraté.
jer crois que c que quand il y a des H, non?
d'habitude on ne raojute jamais d H2O ds les produits. Explique moi stp j ai un petit controle demain merci

Lis ce que j'ai marqué dans mon message précédent

Mais ce cas ne se vérifie pas pour NaCl(s) ....> Na=(aq) + Cl-(aq) en présence d'eau ? le résultat ne contient pas de H2O pourtant?

Dans une équation de dissolution, tu ne prends pas en compte H2O Tu t'intéresses seulement aux ions onstituant le solide ionique
Tu t'intéresses seulement aux ions onstituant le solide ionique
Bonjour, notre prof nous a donné un exercice. J'aimerais avoir de l'aide.
Merci d'avance.
L'acide nitrique HNO3 est un liqude moléculaire à caractere dipolaire; cette dissolution dans l'eau libère des ions oxonium et des ions nitrate.
a-écrire l'équation de la dissolution de l'acide nitrique dans l'eau.
b-sur un flacon d'acide nitrique, on releve les informations suivantes:
acide nitrique: 68%; d=1.41. M= 63.0g/mol
Calculer la concentration molaire de la solution contenue dans le flacon.
c-Quel volume Vo de cette solution doit on prélever pour préparer 500mL de solution tel que:
[NO3-(aq)]=0.10 mol/L?
merci d'avance.
*** message déplacé ***
Bonojur j'aurais besoin d 'aide pour un exercice
L'acide nitrique HNO3 est un liqude moléculaire à caractere dipolaire; cette dissolution dans l'eau libère des ions oxonium et des ions nitrate.
a-écrire l'équation de la dissolution de l'acide nitrique dans l'eau.
b-sur un flacon d'acide nitrique, on releve les informations suivantes:
acide nitrique: 68%; d=1.41. M= 63.0g/mol
Calculer la concentration molaire de la solution contenue dans le flacon.
c-Quel volume Vo de cette solution doit on prélever pour préparer 500mL de solution tel que:
[NO3-(aq)]=0.10 mol/L?
Pour la question 1 je crois que c'est: HNO3 (l)+H2O (l)......>H3O+ + NO3- (aq)
merci d'avance
*** message déplacé ***
Ben tu as les réponses aux questions précédentes plus haut...
c) Au cours d'une dilution, la quantité de matière se conserve donc n0 = n
D'où C0V0 = CV
C0 tu l'as calculée au b).
Tu fais donc V0 = (CV)/C0
V0 = (0,10*0,500)/C0 = ... L
pour la 1) j ai trouver HNO3 (l) + H2O .....> H3O+ + NO3-(aq) .
2) 68 *1.41.10^3 :100 = 9.59 * 10^2 g.
3) co*vo=c*v
vo=(0.10*0.500)/15.2=3.29*10^ -3 L
1) HNO3 ---> H3O+ + NO3- suffit

2) La densité est la masse d'un litre de solution donc mthéorique = 1,41 kg
Or, cette solution n'est pûre qu'à 68% donc mréelle = (68/100)*1,41 = 0,96 kg = 960 g.
n = m/M = 960/63,0 = 15,2 mol.
c = n/V = 15,2/1,00 = 15,2 mol.L-1
3) Refais ton dernier calcul avec la bonne valeur

Slt. C'est la bonne valeur dans la question 3) non? Qu'est-ce qui est faux? je trouve Vo= 3.29*10^ -3L.
Encor merci pour ton aide.
Laura-Croft
Non car tu avais la mauvaise valeur à la question 2)...
Il faut que tu changes la valeur de la concentration molaire

3) Ben c'est bon alors
Tu n'avais pas marqué 15,2 mol.L-1 à la fin du 2), d'où la confusion
Donc c'est parfait