Inscription / Connexion Nouveau Sujet
Représentation de Lewis du Saccharose
Bonjour !
Voici mon premier post sur ce forum fort sympathique 
Et voilà ma question :
Quelle est la représentation de Lewis du Saccharose ?? 
Sa formule est C12 H22 O11.
J'ai trouvé cette image jointe sur Wikimedia, mais... est-ce si compliqué que ça ?!
Merci de votre réponse !
A+
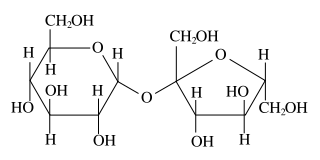
Bonsoir et bienvenue,
En effet ce n'est pas une molécule aussi simple que le methane ni meme que le benzene.
Wikipedia ne se trompe pas, d'autres sites donnent la meme chose.
Reste à savoir pourquoi on te pose cette question bille en tete dans un ex de chime de 2nde?
Peut etre justement pour te forcer à te documenter sur internet ou dans une bibliotheque?
Oui ça doit être ça... mais effectivement j'avais un doute quant à la complexité de la représentation... sachant qu'on en était à des représentations + simples !
En tout cas merci de cette (rapide) réponse !! 
Bonsoir,
La représentation que donne Wikipédia n'est pas une représentation de Lewis mais une représentation de Haworth. La représentation de Haworth est notamment utilisée en biochimie pour les glucides, mais moi je n'ai eu l'occasion de la voir que post-bac !
Je suis quand même étonnée que ton prof t'ait donné le saccharose à dessiner en Lewis, c'est absurde !
Tout ce que tu as besoin de savoir c'est que les atomes d'oxygène font deux liaions et ont deux doublets non liants, que les atomes de carbone font quatre liaisons et les atomes d'hydrogène n'en font qu'une.
Bon courage,

Bonjour! (je post sur ce sujet car il est semblable au mien)
Je suis en 1ere S et il faut aussi que j'écrive la formule de lewis du saccharose ! Petit problème : je n'ai jamais appris ce système de représentation en 2nd ! Une petite aide serait donc la bienvenue !
Merci d'avance !
Salut!
Pour poursuivre ce qu'a dit Orsolya, une méthode qui te permet de construire ta représentation:
Écrit le nom et la formule brute de la molécule.
Écrit la structure électronique de chaque atome.
Trouve le nombre ne d'électrons externes de chaque atome.
Trouve le nombre nl de liaisons covalentes que doit établir l'atome pour acquérir une structure en octet (8 - ne ) ou en duet (2 - ne ) suivant la règle à laquelle il est soumis
Trouve le nombre nnl de doublets non liants de chaque atome grace à cette formule c'est + simple:
nnl=(ne-nl)/2
On peut alors dessiner la représentation de Lewis :
Place le(s) doublet(s) liant(s) entre les atomes de la molécule (liaisons covalentes).
Place le(s) doublet(s) non liant(s) autour des atomes qui en possèdent
Vérifie que chacun des atomes de la molécule satisfait à la règle de l'octet en étant entouré de 4 doublets (ou d'un seul doublet pour la règle du duet).
Ok? C'est vrai qu'elle est dûre pour un(e) seconde
Ah Bad Goone est partout c'est une infction ^^
Le probléme en fait c'est qu'il y a une forme cyclique et je vois pas comment on peu satsifaire la régle des liasons avec la représentation de lewis ?
Non je sais sais sa peut être bizarre mais t'inquiète je pense que y'a que lui qui peut comprendre ^^


