Inscription / Connexion Nouveau Sujet
Representation de Lewis
Bonjour, un petit exercice de chimie que j'aimerais que vous vérifiez. 
L'énonce :
On considère la molécule de formule brute C2H5NO.
1 Calculer le nombre doublets liants et non liants de la molécule.
Ma rep : Hydrogène : (1-1)/2 = 0
Carbone : (4-4)/2 = 0
Azote : (5-3)/2 = 1
Oxygène : (6-2)/2 = 2
Donc l'hydrogène et le carbone ont 0 doublet non liants, l'azote a 1 doublet non liants et l'oxygène a 2 doublets non liants.
2 Combien de liaisons covalentes ces atomes doivent-ils établir pour obtenir une structure électronique en duet ou en octet ?
Ma rep : Il 3 liaisons covalentes pour obtenir une structure électronique.
3 Écrire une formule de lewis possible (non cyclique) de cette molécule.
Formule à la fin du message
4 Rappeler la définition de deux isomères.
Ma rep : Deux molécules sont isomères lorsqu'elles ont la même formule brute mais pas la même formule développée.
5 Écrire la formule développée (ou semi-développée) de 2 autres isomères non cycliques de formule brute C2H5NO.
Ma rep :
Butane:
CH3-CH2-CH2-CH3
Méthylpropane :
CH3-CH-CH3
|
CH3
Voilà merci d'avance pour votre aide.
La formule de la question 3 :
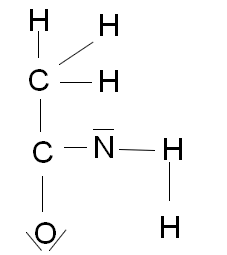
Bonjour
1) ok mais tu n'as pas calculé le nombre de doublets liants pour chacun !!
2) non ! Ces trois atomes réalisent un nombre différent de liaisons covalentes
3) Comme la 2 est fausse du coup celle ci aussi est fausse !
1) Le nombre de doublets liants :
Hydrogène : z=2-1=1
Carbone : z=8-4=4
Azote : z=8-5=3
Oxygène : z=8-6=2
2) 4 alors ? :/
Sinon, les question 4 et 5 sont bonnes ?

1) ok
2) non pour chaque atome le nombre de doublet liant est égal au nombre de liaison covalente que l'atome doit réaliser !
2) Il faut que tu dises pour le carbone combien il y en a, pour l'azote combien il y en a, pour l'oxygène combien il y en a et pour l'hydrogène combien il y en a (ce n'est pas le meme nombre à chaque fois...)


