Inscription / Connexion Nouveau Sujet
Réactions d'oxydoréduction et bilan de matière
Bonjour 
a. Ajuster la stoechiométrie de l'équation quivante:
S(2)0(3)²- + I(2) --> S(4)O(6)²- + I-
b. pourquoi peut on être sûr qu'il s'agit d'une équation d'oxydoréduction ?
c. Quel volume minimal V d'une solution de concentration c=0.050mol/L en ions thiosulfate S(2)0(3)²- faut-il ajouter pour décolorer complètement une solution contenant 2.5 X 10^-3 mol de diiode?
d. Quelle quantité de matière d'ions I- a été formée ?
Réponse:
a. en écrivant à l'avance les deux demi equation, je trouve :
2(S(2)0(3)²-) = S(4)O(6)²- + 2e-
I(2) + 2e- = 2I-
2(S(2)0(3)²-) + I(2) + 2e- = S(4)O(6)²- + 2e- + 2I-
b. Nous sommes sûr qu'il s'agit d'une équation d'oxydoréduction puisque c'est une réaction où nous observons un transfert d'électron.
c. et d. je n'y arrive pas à y répondre.
Merci de votre aide 
Bonjour
a) Quand tu écris une équation-bilan il ne faut jamais faire apparaitre les électrons ! Et penses aussi à indiquer en indice l'état physique de chaque constituant (meme si ici on sait que tout est à l'état aqueux) !
Ca donne donc : 2S2032-(aq) + I2(aq) = S4O62-(aq) + 2I-(aq) OK?
b) oui mais j'ajouterais une petite chose (par contre je ne sais pas si tu l'as vu) : les nombres d'oxydation ?
c) Il faut que le réactif limitant soit le diiode I2 ! Donc que faire d'après toi ?
d) Quel moyen as-tu à ta disposition pour calculer la quantité de matière d'un produit ?
a) ok d'accord je comprend 
b) non je n'ai pas encore vu sa...
c)* si le diiode i(2) est le réactif limitant donc xmax = 2.5 X 10^-3 mol
*Je calcule le volume dans un premier temps
je fais V= n/C
V = 2.5 X 10^-3/0.050
V=5.0 x 10^-2 L est ce cela ?
d) les nombres stoechiométrique non ?
b) bon alors laisse tomber les nombres d'oxydation (j'ai vérifié ce n'est pas à ton programme...) ! Je pense qu'il faut dire ici qu'il y a l'oxydant (I2) d'un couple qui réagit avec le réducteur (S2O32-) d'un autre couple pour donner le réducteur et l'oxydant associés et qu'il y a, effectivement, échange d'électrons.
c) non non ! Fais un tableau d'avancement ca sera plus facile !
d) oui mais c'est surtout le tableau d'avancement ! C'est lui qui te permettra de calculer n !
Bonjour,
je n'arrive pas à calculer le noimbres de mol ions thiosulfate S(2)0(3)²-
merci de bien m'aider
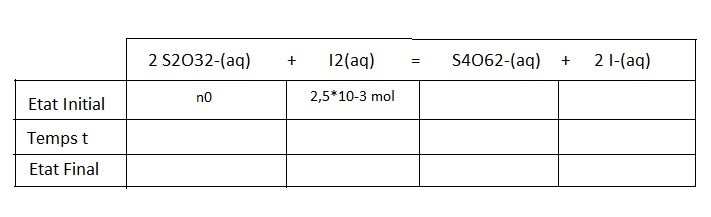
état initial: n0; 2.5*10^-3mol ; 0; 0
etat intermédiaire: n0-2x ;2.5*10^-3-2x; x; 2x
etat final: n0-2xmax ;2.5*10^-3-2xmax; xmax; 2xmax
voila  je ne vois pas en quoi sa répond a ma question
je ne vois pas en quoi sa répond a ma question 
Très bien ce que tu as fais !!!
Donc xmax vaut combien dans ce cas ? (rappelle toi ce qu'on a dit précédemment...)
oh je n'avais pas vu une petite erreur que tu as faite :
A l'état final, pour n(I2), tu as mis : n(I2)=2.5*10^-3-2xmax NON !!!Le coefficicent stoechiométrique du diiode est 1 !!! Attention !!!
voila n0=5*10-3 mol donc connaissant c tu peux en déduire V tout simplement !!! Ce n'est pas plus cimpliqué que ca !!!