Inscription / Connexion Nouveau Sujet
Réaction rédox
Bonjour a tous j'ai un exercice qui bloque dans mon devoir
Le voici :
On place un excès de cuivre (en tournure) dans 10 mL d'une solution de nitrate d'argent (Ag+ + NO-3 ).
a. Écrire l'équation de la réaction qui se produit. (1 point)
b. Quelle sera la couleur de la solution quand tous les ions Ag+ auront disparu ? Pourquoi ? (1 point)
Lorsque la réaction est terminée, on pèse la masse d'argent formé : m = 1,08 g.
c. Construire un tableau d'avancement et en déduire la quantité d'ions Cu2+ formés. (2 points)
d. Quelle est la concentration (en mol.L-1) de la solution en ions Cu2+ à la fin de la réaction ? (1 point)
Donnée : masse molaire : Cu : 108 g.mol-1.
J'ai juste répondu a la question b , en disant que la couleur de la solution sera bleau turquoise car il y'a présence d'ions Cu2+
Merci a tous ceux qui voudront bien m'aider 
Salut,
Toujours lire l'énoncé jusqu'au bout, car il te donne tous les éléments pour répondre à la première question :
On place un excès de cuivre (en tournure) dans 10 mL d'une solution de nitrate d'argent (Ag+ + NO-3 ).
a. Écrire l'équation de la réaction qui se produit. (1 point)
b. Quelle sera la couleur de la solution quand tous les ions Ag+ auront disparu ? Pourquoi ? (1 point)
Lorsque la réaction est terminée, on pèse la masse d'argent formé : m = 1,08 g.
c. Construire un tableau d'avancement et en déduire la quantité d'ions Cu2+ formés. (2 points)
d. Quelle est la concentration (en mol.L-1) de la solution en ions Cu2+ à la fin de la réaction ? (1 point)
Donnée : masse molaire : Cu : 108 g.mol-1.
1. Les couples en jeu sont Ag+/Ag et Cu2+/Cu
Réactifs :
Ag+ apporté par la solution de nitrate d'argent
Cu en excès
Produit :
Cu2+
Ag
( Ag+ + e- --> Ag ) x2
Cu --> Cu2+ + 2e-
______________________
Cu + 2Ag+ --> Cu2+ + 2Ag

2. Oui ! TB ! Du fait de la présence des ions Cu2+, la solution sera de couleur bleu
3. Du fait que le cuivre Cu est en excès, on devine que l'ion Ag+ est le réactif limitant.
L'équation de la réaction est :
Cu + 2Ag+ --> Cu2+ + 2Ag
Pour une mole de Cu réagissant avec deux moles de Ag+, il se forme 2 moles de Ag et 1 mole de Cu2+.
donc on peut écrire (tu peux retrouver cela par un tableau d'avancement)
Merci beaucoup pour ton aide , je suis entrain de faire mon tableau d'avancement j'espere qu'il sera juste , je mettrais une image plus tard , je crois qu'il va falloir que je prenne quelque cours sur ces tableaux 
Salut,
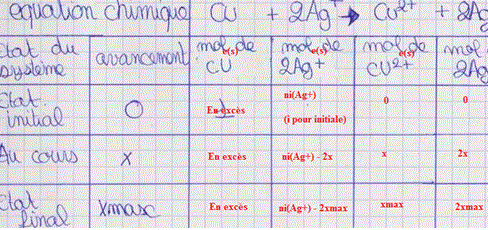
A l'état maximal, tous l'ion Ag+ a réagi (car Cu en excès), sa quantité de matière est nulle :
ni(Ag+) - 2xmax = 0 <=> xmax = ni(Ag+)/2
mais d'après ton tableau d'avancement à l'état maximal :
xmax = n(Cu2+) = n(Ag)/2
<=> [Cu2+].Vtotal = m(Ag)/(2M(Ag))




 et recadrée. Merci d'en faire autant la prochaine fois !
et recadrée. Merci d'en faire autant la prochaine fois ! 



 !
!

