Inscription / Connexion Nouveau Sujet
Réaction et tableau d'avancement (mol)
Bonjour à tous,
J'essaie de m'entrainer pour l'année prochaine ne plus avoir de lacunes, mais je n'arrive vramiment pas à résoudre cet exercice d'entrainement. Si ovus avez d'autres exercices je suis volontaire pour les faire.
Merci
Ex. : On considére la combustion d'une mole de glucose de formule C6H12O6 dans 6 moles de dioxygène. Cette transformation conduit à la formation de dioxyde de carbone et de la vapeur d'eau.
- Ecrire l'équation de la réaction
- Etablir le tableau 'avancement
- Sur un unique graphique, tracer les courbes représentant l'évolution des quantités de matière n(glucose), n(O2), n(CO2) et n(H2O) en fonction de x au cours de la transformation. On placera x en abscisse.
- Déterminer la masse de chaque espèce à l'état final.
Aidez moi à comprendre et à réaliser cet exercice, afin de pouvoir en réaliser d'autre, et ainsi combler mes lacunes. Merci. Djabdel
Re-bonjour !!
1) 1 mole de C6H12O6 réagit avec 6 moles de O2. Donc ca donne : C6H12O6 + 6O2 = ... ?
2) Comme pour l'autre exo, ca donne quoi?
mais non on te dit que :
Cette transformation conduit à la formation de dioxyde de carbone et de la vapeur d'eau.
Voici une correction de ton tableau :
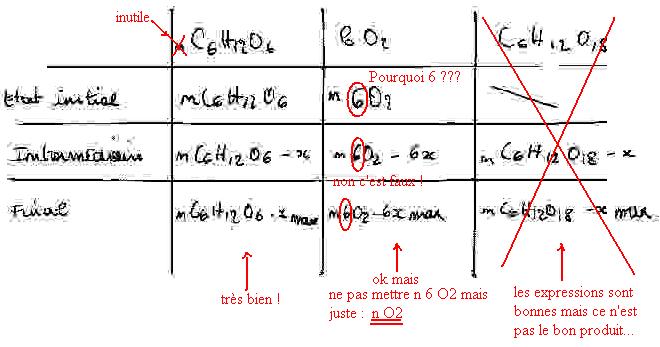
J'ai mis 6, parce que l'énoncé nous dit que
la combustion d'une mole de glucose de formule C6H12O6 dans 6 moles de dioxygène
Donc si je comprend bien, l'équation est :
C6H12O6 + 6O2 = 6CO2 + 6H2O
C'est bien cela ?
J'ai mis 6, parce que l'énoncé nous dit que "la combustion d'une mole de glucose de formule C6H12O6 dans 6 moles de dioxygène", donc 6 moles ? /quote] non : il faut 6 fois plus de O2 que de C6H12O6 pour qu'il y ait réaction. A l'état initial on a n(O2) mol de O2 et n(C6H12O6) mol de C6H12O6 !! Après à l'état intermédiaire, on fait intervenir ce "6" mais pas avant !!
[quote]Donc si je comprend bien, l'équation est : C6H12O6 + 6O2 = 6CO2 + 6H2O C'est bien cela ?
pardon erreur de frappe :
J'ai mis 6, parce que l'énoncé nous dit que "la combustion d'une mole de glucose de formule C6H12O6 dans 6 moles de dioxygène", donc 6 moles ?
quote]Donc si je comprend bien, l'équation est : C6H12O6 + 6O2 = 6CO2 + 6H2O C'est bien cela ?
il faut 6 fois plus de O2 que de C6H12O6 pour qu'il y ait réaction. A l'état initial on a n(O2) mol de O2 et n(C6H12O6) mol de C6H12O6 !! Après à l'état intermédiaire, on fait intervenir ce "6" mais pas avant !!
Je ne sais pas où et comment utiliser cette donnée...
D'accord, donc le réactif limitant correspond à l'équation :
6 nO2 - 6xmax = 0 , c'est bien cela ?
Mais on ne peut pas réaliser l'évolution sur un graphique alors ?
ici les deux réactifs sont limitants vu qu'ils ont été introduits en proportion stoechiométrique (meme quantité que leur nombre stoechio)
on le sait parce qu'on a n(C6H12O6)=1-x mol et n(O2)=6-6x mol. Que vaut x pour qu'au moins un des deux réactifs "disparaisse" (n=0)?
x = 1 pour que les 2 réactifs disparaissent.
Mais les graphiques, on ne peut les tracer par contre ?
ok, mais j'avoue que je suis un peu pommé.
Car si je remplace x, comment je dois faire pour trouver n(...) ?



