Inscription / Connexion Nouveau Sujet
réaction chimique et couleur - tableau d'avancement
Bonjour à vous tous,
j'ai un dm pour lundi et j'aurai besoin de votre aide.
Voici l'énoncer:
Pour synthétiser un pigment, on mélange un volume V1= 20.0 ml de solution
de sulfate de fer(III) de concentration C1=1.0*10-1 mol.L-1
et un volume V2=30.0 ml de solution d'hexacyanoferrate (II) de potassium de concentration C2= 1.0*10-1 mol.L-1.
L'équation de la réaction qui se produit est:
4Fe3+(aq) + 3Fe(CN)64-(aq) => Fe4[Fe(CN)6]3(s)
C1= [Fe3-]
C2= [Fe(CN)64-]
Sachant que M(Fe4[Fe(CN)6]3(s)) = 858,6 g.mol-1
1. Calculer les quantitées de matières initiales des réactifs ?
J'ai utilisé n1= C1*V1
= 1.0*10-1*0.02
= 0.002 mol
= 2.0*10-3 mol
et pareil pour n2= C2*V2
=1.0*10-1*0.03
= 0.003
Est-ce bien ça ?
2. Faire le tableau d'avancement :
Equation 4Fe3+ 3Fe(CN)64- Fe4...
x=0 2.0*10-3 3.0*10-3 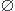
etape intermédiaire 4x 3x x
x 0 0.002-4x 0.003-3x x
0 0.002-4x 0.003-3x x
x = xmax 0.002-4xmax 0.003-3xmax xmax = ?
= ?
3. Determiner la valeur de l'avancement max et le réactif limitant.
4. Calculer les quantités de matières à l'états final ?
5. Quelle masse max peut on esperer obtenir ?
Est ce bon ou est ce que mes calcule sont faux ?
Je suis bloqué ici, pouvez-vous m'aider s'il vous plait ?
Cordialement.



