Inscription / Connexion Nouveau Sujet
réaction chimique
Bonjour, j'aurais besoin d'aide pour cet exercice :
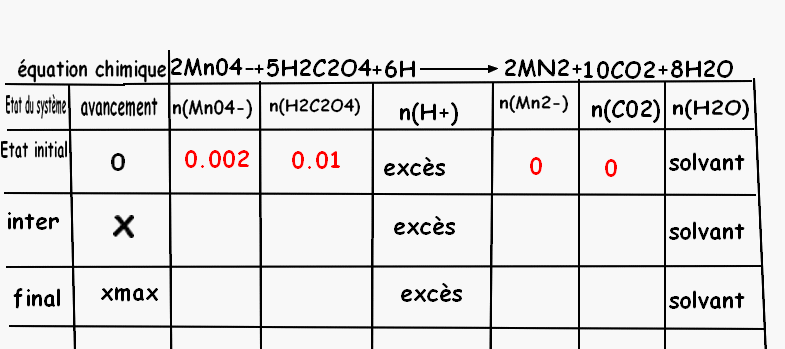
Une solution incolore d'acide oxalique, de formule H2C204(aq) est mélangée a une solution violette de permanganate de potassium, en milieu acide. La seule espèce colorée du système étudié est l'ion permanganate, MnO4(aq) de couleur violette. Initialement, on a mélangé un volume V1=20.0ml de solution d'acide oxalique à la concentration C1=0.50mol/l avec un volume V2=5.0ml d'une solution acidifiée de permanganate de potassium de concentration C2=0.40mol/l en ion permanganate. L'acide est en excès et l'eau constitue le solvant de la solution.
a) Quel est le réactif limitant ?
b) Calculer les quantités initiales n1 et n2 en mol.
c) Compléter la fin du tableau d'avancement.
J'ai fait :
a) ?
b) n1=V1xC1=20^-3x0.5=0.01mol
n2=V2xC2= 5^-3x0.4=2^-3mol
c)mes réponses sont en rouge mais je ne sais pas remplir le reste du tableau
merci de m'aider