Inscription / Connexion Nouveau Sujet
Réaction acido basique et conductimétrie
Bonjour, j'ai un exercice à faire et j'avoue que la partie II me pose problème, le voici :
L'eau de Vichy St Yorre est une eau bicarbonatée. Elle contient l'ion hydrogénocarbonate (HCO3-) anciennement appelé bicarbonate en grande quantité ainsi que de sions chlorures.
Sur l'étiquette d'une bouteille, on lit :
Composition moyenne en mg/L : bicarbonates 4368
chlorures 322
Le but de l'exercice est de vérifier ces deux compositions moyennes. Les deux parties sont indépendantes.
Données :
-L'ion hydrogénocarbonate HCO3- appartient au couple CO2, H2O / HCO3-
-M(H)=1,0g/mol ; M(C)=12,0g/mol ; M(O)=16,0g/mol ; M(Cl)=35,5g/mol
-Conductivités molaires ioniques à 25°C :
 (Ag+)=6,19.10-3S.m².mol-1 ;
(Ag+)=6,19.10-3S.m².mol-1 ;  (NO3-)=7,14.10-3S.m².mol-1 ;
(NO3-)=7,14.10-3S.m².mol-1 ;  (Cl-)=7,63.10-3S.m².mol-1
(Cl-)=7,63.10-3S.m².mol-1
Partie I :
On dose les ions hydrogénocarbonate contenus dans l'eau de Vichy à l'aide d'une solution d'acide chlorhydrique, de concentration en soluté apporté CA=0,10mol/L.
On utilise comme indicateur coloré le vert de Bromocrésol (jaune en milieu acide et bleu en milieu basique).
Lorsqu'on dose 20,0 mL d'eau de Vichy, on atteint l'équivalence en versant un volume Veq = 14,4 mL d'acide chlorhydrique.
1) Donner les couples intervenant, ainsi que la demi-équation correspondant à chacun.
Je l'ai fait
2) Quel type de réaction a lieu lors du dosage ? Justifier
J'ai mis que c'était une réaction acido basique car transfert de ions H+
3) Etablir l'équation de la réaction :
HCO3- + H3O+  CO2 + 2H2O
CO2 + 2H2O
4)5) J'ai fait
6) Etablir le tableau d'avancement à l'équivalence (Je l'ai fait) et en déduire la concentration en ions hydrogénocarbonate de l'eau de Vichy.
j'ai trouvé C=7,2 * 10-2 mol/L ... Est ce bon ?
7) Comparer le résultat trouvé avec l'indication de l'étiquette :
J'ai trouvé t=4,4 g/L donc environ l'indication de l'étiquette.
Je poste déja cette partie puis la deuxième après.
Partie II :
Les ions chlorure réagissent par précipitation avec les ions argent Ag+. Le chlorure d'argent formé est un solide blanc.
La transformation peut être modélisée par l'équation :
Ag+ + Cl-  AgCl
AgCl
On réalise le titrage conductimétrique des ions chlorures contenus dans 25,0 mL d'eau de Vichy St Yorre à l'aide d'une solution de nitrate d'argent de concentration en soluté apporté c=2,5*10-2 mol/L.
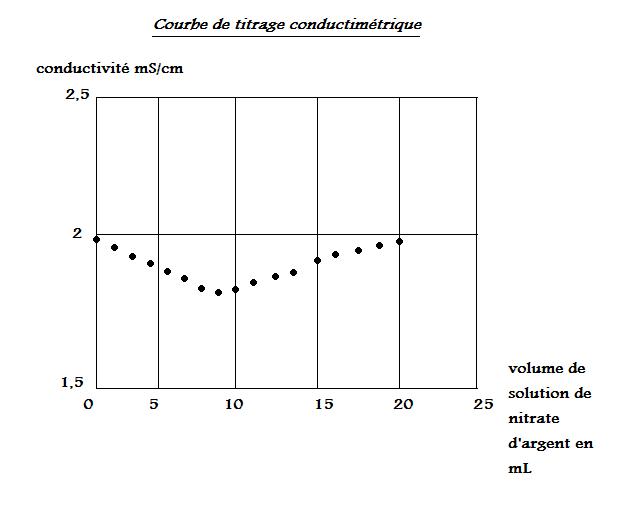
On trace l'évolution de la conductivité  au cours du titrage en fonction du volume de solution de nitrate d'argent versé. Voir annexe.
au cours du titrage en fonction du volume de solution de nitrate d'argent versé. Voir annexe.
1)
a) Déterminer graphiquement le volume de solution de nitrate d'argent versé à l'équivalence (J'ai mis 9mL)
b) Justifier, sans calculs, la diminution de la conductivité avant l'équivalence.
J'ai mis : La conductivité est influencé par la concentration de la solution. Avant l'équivalence, on remarque une diminution de la conductivité car il y a diminution de la concentration. Est ce bon ?
c) Meme question après équivalence donc réponce inverse.
2)
a)Etablir le tableau d'avancement à l'équivalence
b) En déduire la concentration en ions chlorures de l'eau de Vichy.
3) Comparer le résultat trouvé avec l'indication de l'étiquette.
La j'avoue que la question 2) et 3) je ne sais pas du tout comment faire.
Faut il prendre comme équation celle donné dans l'énoncé ? Et à quoi servent les conductivité molaires ioniques données dans les données ?
Merci beaucoup de votre aide
PS : C'est a peu près le graphique donné dans l'annexe.
Bonjour,
Il faut que tu détailles plus tes réponses aux questions. Tu t'imagines bien que ça fait gagner du temps aux correcteurs 
Bien enfaite la partie I je pense avoir bon donc plus besoin de s'attarder dessus c'est surtout la partie II qui me pose problème, et la je ne peux pas plus détailler mes réponses car je n'en n'ai pas xD
D'abord, je te conseille de toujours faire un schéma annoté du dosage et de réecrire sur ta copie l'éuqation de la réaction du dosage.
Je vais te faire un modèle de rédaction 
* Schéma annoté du dosage :
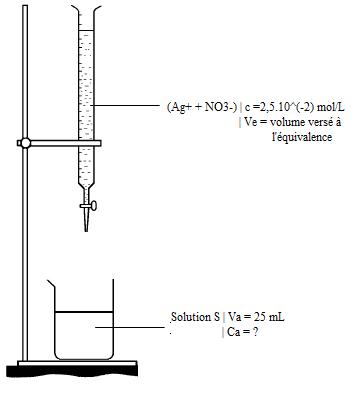
* L'équation de la réaction du dosage est Ag+ + Cl- --> AgCl
1. a. On lit l'abscisse du point intersection des deux droites de pentes différentes.
On a Ve = 9 mL.
b. Par définition, la conductivité de la solution est donnée par  =
=
 i.[Xi].
i.[Xi].
Ici,  =
=  (Ag+).[Ag+] +
(Ag+).[Ag+] +  (Cl-).[Cl-].
(Cl-).[Cl-].
Au fur et à mesure qu'on verse la nitrate d'argent dans le bécher, la concentration en ion Cl- diminue puisqu'il réagit avec Ag+ => avant l'équivalence, la conductivité de la solution diminue.
c. A l'équivalence, tous les ions Cl- ont réagi donc après l'équivalence, l'ajout de nitrate d'argent dans la solution augmente la conductivité.
2. a. Je te laisse faire le tableau d'avancement, je n'en ai pas besoin.
b. L'équivalence est atteinte quand les réactifs de la réactions du dosage ont été introduits dans des proportions stoechiométriques.
Ainsi, à l'équivalence,
<=> C.Ve = Ca.Va
<=>
Application numérique : je te laisse la faire.
3. Je te laisse conclure quand à la validité du résultat.
_______________________________________
As-tu des questions ? 
Nulle part. C'est juste pour justifier le tracé de la courbe. Puisqu'on a la courbe, il n'y a pas de calcul à faire 


