Inscription / Connexion Nouveau Sujet
Questionnaire concernant les liaisons covalentes et molécules
Salut tout le monde ! J'aurais besoin de votre aide pour un travail que je devrai rendre un peu après les vacances d'été. Voici donc quelques questions concernant les liaisons covalentes et les molécules auquelles vous pouvez répondre pour mon petit sondage. Pour les 2 premières questions, répondez simplement par oui ou non et pour les autres questions, essayez de développer un peu! Merci d'avance !
1) Savez-vous où trouver les informations nécessaires dans un tableau périodique (nombre d'électrons de Valence, de liaisons que peut faire un atome, et de paires libres)?
2) Savez-vous lier plusieurs atomes entre-eux ? Avez-vous eu des difficultés à comprendre la théorie ?
3) Etes-vous capable de dessiner une molécule à partir d'une formule brute, semi-développée autant de manière développée que sténographiée? Quels ont été les problèmes dans l'apprentissage ?
4) Etes- vous capable de dire quelle est la forme de certaines molécules ? Qu'est-ce qui est compliqué à apprendre, où sont les difficultés ?
5) Etes-vous capable de dire si une molécule est polaire ou apolaire ? Quelles sont vos difficultés par rapport à la polarité ou quelles ont-elles été ?
bonjour ,
1- oui
2- oui / non
3- oui / problème pour être exhaustive et ne pas oublier d'isomère.
4- apres mure réféxion , oui . Ce n'est pas tant que ce soit compliqué à apprendre mais que l'utilisation de la forme d'une molécule est restreinte au niveau lycée , et on oublie la théorie sans la pratique ...
5- oui, je pense.../ la difficulté augmente avec la taille de la molécule sans doute , pas vraiment testé sur de grosse molécules.

Salut!
Puisque c'est un sondage
1) oui
2) oui/non
3) oui/je dirais que les problèmes venaient au début des isomères qd il y avait une double liaison: j'en trouvais trop...
4) oui et après plusieurs vérifications si la molécules est compliquée... (enfin je suppose que forme signifie linéaire, trigonale plane, bipyramide à base trigonale...)/ce n'est pas vraiment compliqué à apprendre, c'est comme toute théorie... Les difficultés viennent souvent du fait que ce ne soit pas vraiment approfondi en cours, si on ne fait pas soit même des exos, je pense que ça doit coincer...
5) oui/ par rapport au niveau première niet... ensuite je ne sais pas par rapport à la suite...
En espérant t'avoir aidé
Bonjour,
1) Oui
2) Oui/Non
3) Oui/ Les isomères ^^
4) Oui/ De même, très peu approfondi au lycée. Quand on connait la méthode VSEPR, ca devient bien plus simple
5) Oui/
Skops 
moi aussi j aurais répondu les isomères ^^ mais seulement pour la forme sténographiée ! En tout cas merci pour vos réponses!
Si tu veux une précision je te dirais juste que je me suis un peu trop avancée sur les programmes à venir... Ce qui fait que je trouve parfois des isomères avec d'autres méthodes... et je me fais taper sur les doigts car je n'utilise pas les mêmes méthodes que le prof....
Si je peux me permettre une légère remarque: ta question 3 se rapproche qd même de la 2 (de part l'idée générale): si tu sais former une molécule, tu es capable de la dessiner
oui, je sais que ces 2 questions se rapprochent beaucoup. Mais par la question 2, j'entendais ca d'une manière plus théorique, est-ce que vous savez lier plusieurs atomes entre eux ? dans le sens : savez vous comment "utiliser" les électrons de Valence pour lier 2 atomes entre eux... je sais pas si tu vois ce que je veux dire... mais c'est clair que ca se rapproche beaucoup lol
oui c'est un sondage ! je sais que je ne vais pas trouver beaucoup d'opinions et c'est bien parce que je n'en ai pas assez que je le poste sur des forums... mais c'est vrai que ca ne marche pas beaucoup... et comme je ne connais pas beaucoup de gens qui connaissent au moins les bases en chimie... voila quoi... pour l'instant, j'en ai fait remplir à des gens de ma classe et à quelques autres amis qui prennent des cours de chimie et puis sur les forums... mais je pense que pour l'instant j'arrive à 30 sondages remplis à tout casser... donc c'est vrai que ca n'est pas facile !
Bonsoir à toutes et à tous 
Voici mes réponses :
1)- oui
2)- oui ~ non
3)- oui >> aucun problème d'apprentissage à ce niveau-là.
4)- oui ~ je ne connais que les molécules basiques car mes profs ne m'ont jamais vraiment montré d'autres molécules...
5)- non car je ne sais pas ce que cela veut dire.
Jb. 
Pour JBT : merci pour tes réponses ^^ dis tu entends quoi par molécules basiques ? tu as un exemple de la molécule la plus compliquée que tu aies vu ?
melaniecu ---> Donc tu le postes sur plusieurs forums? C'est ce que j'allai te suggérer autrement
Je pense que JBT parle des molécules que l'on voit en classe...
oui je le poste sur plusieurs forums, 4 en tout, je vais voir si je peux en trouver d'autres interessants.
JB ---> La définition qu'on donne en première est la plus simple:
L'électronégativité d'un élément est la tendance d'un atome de cet élément à attirer le doublet d'une liaison covalente dans laquelle il est engagé.
D'une façon générale: -l'électronégativité des éléments augmente lorsqu'on se déplace de gauche à droite dans une période (ligne) du tableau périodique des éléments;
-l'électronégativité des éléments augmente lorsqu'on se déplace de bas en haut dans une famille (colonne) du tableau périodique des éléments.
Exemple avec HCl:
Le chlore est plus électronégatif que l'hydrogène. Le doublet qui assure la liaison entre ces deux atomes se déplace vers le chlore.
Il apparaît donc, au voisinage de l'hydrogène, une densité électrique positive (notée  +) qui correspond à un déficit électronique sur cet atome.
+) qui correspond à un déficit électronique sur cet atome.
De même, au voisinage du chlore, une densité électrique négative (notée  -) qui correspond à un excès électronique sur cet atome.
-) qui correspond à un excès électronique sur cet atome.
Donc deux pôles électriques différents et distincts aux extrémités de la liaison H—Cl. On dit que cette liaison est polarisée. Il en résulte que la molécule HCl présente un caractère polaire.

Cas de l'eau:
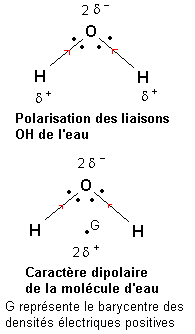
L'électronégativité de l'oxygène est plus forte que celle de l'hydrogène. Une étude du déplacement des doublets de liaison semblable à celle conduite dans le paragraphe précédent montre que les liaisons O—H de la molécule d'eau sont polarisées de telle façon que l'oxygène porte une densité électrique négative (2d-) et que chaque hydrogène porte une densité électrique positive (d+).
Le barycentre des densités électriques positives se situe au milieu du segment joignant les deux atomes d'hydrogène (voir dessin ci-joint). Il apparaît alors qu'étant donnée la forme de la molécule d'eau, les barycentres des densités électriques positives et négatives sont distincts. La molécule d'eau présente un caractère polaire (on dit dipolaire si il y a deux pôles).
Ce caractère dipolaire de la molécule d'eau lui confère des propriétés de solvant très particulier (ce n'est pas le seul solvant dans ce cas). Il peut être mis en évidence par l'expérience présentée ci-dessous. Un bâton de verre frotté avec un drap attire les molécules d'eau.
Ca fait 20 minutes que j'ai commencé ce message (étant donné que j'ai été appelée autre part entre-temps), donc il est possible que vous ayez répondu entre-temps
melaniecu ---> Sur quels forums si c'est pas indiscrets? Je peux t'en donner si tu veux
Skops ---> pas vraiment, j'utilise toutes les configurations que je connais ... Je tourne la molécule dans tous les sens...
... Je tourne la molécule dans tous les sens...
C'est ça le pb quand on s'avance... Je t'avoue que j'ai lu un peu trop de choses en chimie... C'est pour ça que je reprends un peu tout. Autant avoir des bases un peu plus solides
shadowmiko ----> posté sur yahoo, sur-la-toile.com, forums.futura-sciences.com
voila mais c'est vrai que je n'en connais pas beaucoup d'autres...
Je te mettrais tout les forums que je connais plus tard (promis ), là je suis à la bourre.
), là je suis à la bourre.
A+
Pour faire plaisir à Jade (des Pyrénées -ça c'est pour VN-)