Inscription / Connexion Nouveau Sujet
Quantités de matières, combustions, formule brute d'une molécule
Bonjour à tous, j'espère que vous aurez un peu de temps à me consacrer. J'ai la correction d'un contrôle à faire pour mercredi, et je n'y arrive pas. J'aimerai que vous m'éclaircissiez un peu si possible ^^!
Voila le sujet :
On brûle complètement une masse m1 d'un hydrocarbure A ; on recueille une masse m2=7.04g de dioxyde de carbone et une masse m3=2.88g d'eau.
1) Écrire l'équation de la combustion complète d'un hydrocarbure.
2) Déterminer les quantités de dioxyde de carbone et d'eau obtenues ; en déduire le rapport y/x des nombres d'atomes d'hydrogène et de carbone dans la molécule d'hydrocarbure.
3) Déterminer la formule brute de la molécule sachant que sa masse molaire moléculaire est : M (A) = 70 g/mol
4) Donner la formule topologique et le nom de tous les isomères de A. (Bien sûr je comprends que vous ne pourrez pas m'aider pour la formule topologique)
Si vous pouvez m'aider , ou au moins pour une question me donner quelques indications je vous serez très reconnaissante.
Merci de me répondre.
Un début de réponse
équation de réaction (à équilibrer)
CxHy + O2 =CO2 + H2O
En utilisant les masses d'eau et de CO2,calcule n(H2O) et n(CO2)
calcule n(CO2)/n(H2O).
Ce rapport est égal au rapport des coefficients stoechiométriques de CO2 et H2O
Tu obtiens ainsi une relation entre x et y
tu peux alors écrire la formule de l'hydrocarbure en fonction de x seulement
exprime la masse molaire en fonction de x.
Sachant que M=70 g/mol tu en déduit x
Réponse que tu dois obtenir x=5 d'où la formule C5H10 .
Alors, tout d'abord merci de m'avoir répondu.
Voilà ce que j'ai fait :
n(CO2)= m(CO2)/M(CO2)= 7.04/(12 + 2*16) = 7.04/44= 0.16 mol
n(H2O)= m(H2o)/M(H2O)=2.88/(1*2+16)=2.88/18= 0.16 mol
Mais après, je ne comprends pas comment je peux obtenir une relation entre x et y. 
la formule topologique d'un hydrocarbure est une représentation de sa formule développée dans laquelle seules les liaisons entre les carbones sont figurées .
Par exemple CH3-CH2-CH3 se représente par deux segments de droite formant un angle (comme un accent circonflexe)
Les extrémités des segments correspondent aux carbones (que l'on écrit pas).
Les hydrogènes ne sont pas écrits.
par exemple une formule topologique représentée par deux segments perpendiculaires corespond au 2,2-diméthylpropane.
Dans le cas de double liaison C=C on représente 2 traits parallèles.
Cherche sur google "formules topologiques molécules"
Avant de passer à l'écriture topologique qui nécessite un peu d'entraînement,je te recommande de chercher les formules semi-développées des isomères.
CxHy + 15/2 O2 = 5 CO2 + 5 H2O
c'est ça ? 
Parce qu'en fait j'ai pas réussi à l'équilibrer à cause des x et y qui me sont inconnus. C'est pourquoi je me suis aidée de la réponse mais je ne suis pas très sûre de moi =S
CxHy + (x+y/4)O2 =x CO2 +y/2 H2O
les quantités de matière de CO2 et H2O sont dans le même rapport que les coefficients stoechiométriques ;donc
n(CO2)/n(H2O)=x/(y/2)=2x/y
or n(CO2)/n(H2O)=0,16/0,16=1
d'où
2x/y=1 soit y=2x
la formule de l'hydrocarbure est donc CxH2x
M(CxH2x)=70g/mol
essaie de continuer
explication pour l'équilibrage
à gauche x atomes de C il faut donc x CO2 à droite
à gauche y atomes de H il faut donc y/2 H2O (pour avoir y atomes de H)
à droite 2x+y/2 atomes de O. à gauche il faut donc (2x+y/2)/2 molécules de O2 puisque 1 molécule de O2 apporte 2 atomess
(2x +y/2)/2 =x+y/4 ce coefficient n'intervient pas dans ton problème,mais il est bon de savoir le trouver
comme je vais arrêter je te donne une indication de plus
la masse molaire de l'hydrocarbure vaut (12x+2x)g/mol
on peut donc trouver que x=5
Merci encore =D
Alors, voila ce que ça donne pour l'exercice tout entier :
1) CxHy + ((2x+y/2)/2) O2  xCO2 + (y/2) H2O
xCO2 + (y/2) H2O
 CxHy + (x+y/4)O2
CxHy + (x+y/4)O2  xCO2 + (y/2) H2O
xCO2 + (y/2) H2O
2) n(CO2)= m(CO2)/M(CO2)= 7.04/(12 + 2*16) = 7.04/44= 0.16 mol
n(H2O)= m(H2o)/M(H2O)=2.88/(1*2+16)=2.88/18= 0.16 mol
Les quantités de matières de CO2 et de H2O sont dans le même rapport stchiométrique donc :
n(CO2)/n(H2O)= x/(y/2)=2x/y
Or n(CO2)/n(H2O)=0.16/0.16=1
donc 2x/y =1
2x = y
La formule de l'hydrocarbure est donc CxH2x.
3) M(CxH2x)= 12x+2*1*x = 12x+2x = 14x
Or on sait que M(CxH2X)=70g/mol donc 70=14x. x=70/14=5.
On remplace x par 5 : CxH2x = C5H2*5 = C5H10.
La formule brute de la molécule est donc C5H10.
4) Il s'agit de pentène. Je vais maintenant réfléchir aux formules topologiques. Pour l'instant j'en trouve 3, est-ce qu'il faut en trouver plus normalement ??
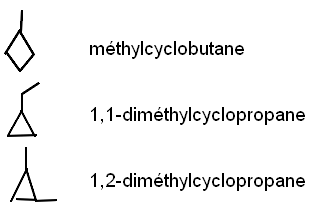
Bon, alors voilà ce que j'ai trouvé pour les isomères du pentène. Mais je crois qu'il me manque des isomères cycliques ... je n'arrive pas à les trouver.
Est-ce que ce que j'ai fait sur l'image est juste ?
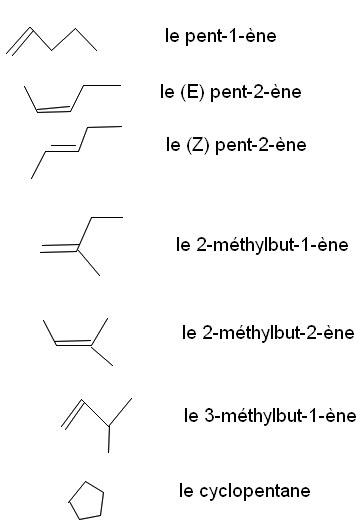
merci! Mais, normalement il ne me manque pas des isomères cycliques ? Parce que je crois que le prof nous avait dit qu'il fallait trouver 10 isomères et je n'en ai que 7 :-/