Inscription / Connexion Nouveau Sujet
Accueil l'île de la physique - chimie Forum de physique - chimieListe de tous les forums de physique - chimie LycéeOn parle exclusivement de physique/chimie, niveau lycée. PremièreForum de première ChimieTopics traitant de Chimie [tout]Lister tous les topics de physique - chimie
Niveau première
Préparation d'une solution : suite
Posté par athrun
Bonjour, cette "suite" correspond en fait à la partie B de l'exercice : elle se fait indépendamment de la partie A.
Voici l'énoncé :
Citation :
On a un volume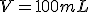 de permenganate de potassium (solution S de concentration en soluté apporté
de permenganate de potassium (solution S de concentration en soluté apporté  ).
).
1. Pour une mesure de conductivité, on veut diluer au dixième cette solution. Indiquer (sans schéma) la verrerie à utiliser pour réaliser de solution diluée à partir de la solution S.
de solution diluée à partir de la solution S.
2. On acidifie un volume de solution diluée en ajoutant 2 gouttes (soit un volume de
de solution diluée en ajoutant 2 gouttes (soit un volume de  ) de solution aqueuse d'acide sulfurique de concentration en solution apporté
) de solution aqueuse d'acide sulfurique de concentration en solution apporté  .
.
a) Ecrire l'équation de dissolution de l'acide sulfurique concentré}) .
.
b) Calculer la conductivité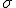 de la solution diluée et acidifiée que l'on doit mesurer.
de la solution diluée et acidifiée que l'on doit mesurer.
Données : Conductivités molaires ioniques des ions à 25°C.
On a un volume
1. Pour une mesure de conductivité, on veut diluer au dixième cette solution. Indiquer (sans schéma) la verrerie à utiliser pour réaliser
2. On acidifie un volume
a) Ecrire l'équation de dissolution de l'acide sulfurique concentré
b) Calculer la conductivité
Données : Conductivités molaires ioniques des ions à 25°C.
Mes réponses : (je ne suis pas sûr de celles-ci...)
1. Il faut une pipette jaugée à
On injecte ensuite ces
2.a) Que signifie le
Je pense que c'est cela :
(en sachant que :
b) Formule :
Passons au cacul de la conductivité
Les ions sulfate, oxonium (ou hydronium), potassium et permenganate sont présents en solution :
Et on a :
La relation devient donc :
La concentration doit être en
On doit donc multiplier par
ce qui revient à tout multiplier par 1, on peut donc laisser les unités telles quelles, en sachant que la conductivité sera donnée en Siemens.
1. OUI
2. a) H2SO4 + 2 H2O = 2 H3O+ +SO42-
b) Comment trouves-tu les différentes concentrations ?
Il faut aussi l'expliquer .
Bonjour,
merci
Ah ok il vaut mieux écrire .
Avec l'équation de dissolution, on trouve d'après les coefficients stoechiométriques que :
Et pour la solution de permenganate de potassium on sait qu'elle a été diluée au dixième.
Que signifie en indice sur
?





