Inscription / Connexion Nouveau Sujet
polymérisation
Bonjour, j'aurais besoin d'un peu d'aide pour un exercice ...
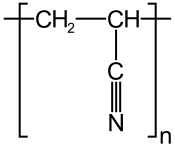
Le voilà : Un polymère a une masse molaire de 79 500g/mol pour un degré de polymérisation n de 1500. Son analyse montre qu'il contient 67,9% de carbone, 26,4% d'azote, le reste en hydrogène.
1) Déterminer la formule brute du monomère ( détaillez vos calculs)
=> ici on ne connait rien sur le monomère
2) En déduire la formule semi-développée du monomère. Il n'y a qu'une solution ! On rappelle que l'hydrogène est monovalent, que le carbone est tétravalent alors que l'azote est trivalent. On pourra par ailleurs envisager des liaisons multiples.
3) Quel est le motif du polymère ?
Bonjour,
1. Tu peux commencer par calculer la masse molaire du monomère, non ?
Ensuite, essaye d'utiliser les pourcentages donnés par l'énoncé.
Bonjour
Le degré de polymérisation correspond au nombre d'unités monomères donc divise la masse molaire par 1500 .
1. Le polymère a une masse molaire et un degré de polymérisation
, donc le monomère a une masse molaire
.
Le monomère est composé de carbone, d'hydrogène et d'azote, donc sa formule brute est de la forme .
Le monomère contient de carbone,
d'azote et donc
d'hydrogène.
On a donc et
.
D'où et
.
Ainsi, la formule brute du monomère est .
S'il y a des points dans ces trois questions qui te posent problème, n'hésite pas à nous demander une explication 
D'accord, merci beaucoup . Oui j'ai quelques questions.
le degré du polymère représente quoi exactement ? La quantité de matière ? Puisqu'on l'utilise dans la formule M = Mn / n ...
Comment sait-on que le monomère est composé de carbone, d'hydrogène et d'azote ?
Quel est la différence entre le monomère et le polymère ?
Je ne comprend pas ça :
P(C)= xM(C) / M ; P(N)= zM(N) / M .... et le reste
Pourquoi fait-on ça ?
La définition du degré de polymère a été donnée sur mon premier post . Sa composition est donnée par une analyse .
Et un polymère est une association de n monomères .
pour le carbone , son pourcentage correspond à la proportion de carbone dans la masse molaire , donc à x atomes de carbone .
le degré du polymère représente quoi exactement ?
Pour parler simplement, un polymère est l'association de n motifs (motif donné par le monomère). Le degré de polymérisation est donc le nombre de fois que tu retrouves le même motif provenant du monomère. Si ton polymère a une masse molaire M' et un degré de polymérisation n, c'est que tu as n fois le motif qui lui (le motif) a une masse molaire M. On a donc n*M=M' d'où M'=M/n.
Comment sait-on que le monomère est composé de carbone, d'hydrogène et d'azote ?
C'est l'énoncé qui le dit ! L'analyse du monomère contient du carbone, de l'azote et le reste est de l'hydrogène. Ça veut bien dire qu'on a uniquement des atomes C, N et H, non ?

Quel est la différence entre le monomère et le polymère ?
Voir plus haut : un polymère est constitué de n motifs (motif qui provient du monomère).
Je ne comprend pas ça :
P(C)= xM(C) / M ; P(N)= zM(N) / M .... et le reste
Pourquoi fait-on ça ?
On sait qu'il y a des atomes de C, N et H mais on veut savoir combien ! On cherche donc à déterminer x, y et z (définis dans mon message plus haut).
Il y a x atomes de C (x est une inconnue qu'on cherche à connaître), donc la masse molaire due aux atomes de C est x*M(C). Or il y en a 69,7% d'après l'énoncé. On a donc x*M(C)/M=69,7% (de même pour N et H).