Inscription / Connexion Nouveau Sujet
Pile cuivre-zinc
Bonjour, j'aimerais avoir de l'aide pour faire cet exercice :
Une pile Daniell est reproduite au laboratoire à partir d'un montage utilisant deux béchers. Le bécher n°1 contient un volume V1=100ml d'une solution de sulfate de cuivre(II) de concentration C1=0,10mol.l et une plaque de cuivre de masse m1=5g. Le bécher n°2 contient un volume V2=100ml d'une solution de sulfate de zinc de concentration C2=0,10mol.l et une plaque de zinc de masse m2=5g. Un pont salin réalise la jonction entre les deux béchers. Les deux plaques métalliques sont reliées à un circuit extérieur. Au cours du fonctionnement de la pile, un dépot rouge se forme sur l'électrode de cuivre.
a) Schématiser la pile zinc-cuivre
b) Ecrire la demi-équation d'oxydoréduction qui traduit la formation du dépot métallique rouge sur l'électrode de cuivre.
c) En déduire le sens des électrons dans le circuit extérieur ainsi que les pôles positifs et négatifs de la pile.
d) Ecrire la demi-équation d'oxydorduction qui a lieu à l'électrode de zinc. En déduire l'équation de la transformation d'oxydoréduction.
e) Calculez les quantités de matières initiales des réactifs et des produits. Quel et le réactif limitant ? Quelle est la masse de la plaque de cuivre à la fin de la transformation chimique ? Celle de la plaque de zinc ?
j'ai fait :
b) Cu=Cu2++2e-
c)Zn2++2e-=Zn
d) Cu+Zn2+ Cu2++Zn
Cu2++Zn
e) n(Cu)=0,078mol, n(Zn2+)=0,01mol et n(Cu2+)=0,01mol, n(Zn)=0,076
C'est le zinc.
f)je pense que mon tableau est faux
merci de m'aider
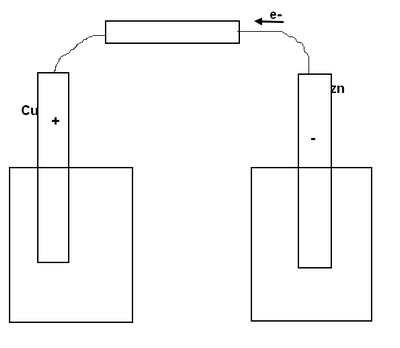
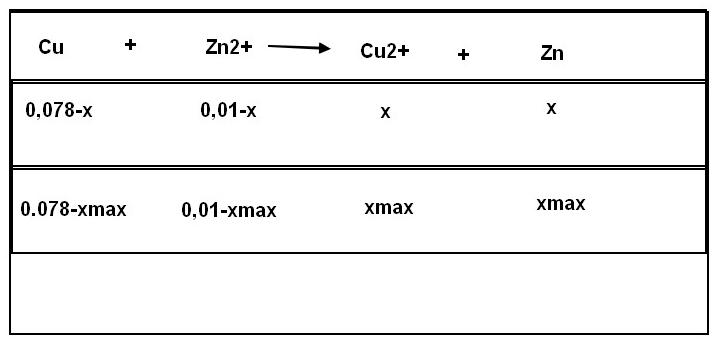
Bonjour manon430, sauf erreur de ma part je pense que tu t'es trompée dés la question 1) reprenons ensemble.
"un dépot rouge se forme sur l'électrode de cuivre. "
Qu'est ce que cela signifie? Un dépot c'est un solide,celui ci se forme c'est donc un produit et dans la partie contenant l'électrode de cuivre tu as Cu et Cu 2+, donc ce dépot, c'est Cu du coup dans t'as deuxieme question ce n'est pas
Cu = Cu2+ + 2e-, mais
Cu2+ + 2e- = Cu, car il y a formation de cuivre.
Tu n'as plus qu'a "inverser" ce que tu as écris par la suite et se sera ok !


