Inscription / Connexion Nouveau Sujet
Physique chimie atomes
Voici mon exercice a faire, j'ai un peu de mal
Le voici:
Une tournure de cuivre a une masse de 5 mg.
1. Calculer la masse approchée d'un atome de cuivre
(Cu:Z=29, A=63).
2. Evaluer le nombre d'atomes contenus dans cet échantillon.
Données:Mn est a peu près égale a Mp; Mp=1,67x10^-27 kg.
Pouvez-vous m'aider s'il vous plait??
Salut Skair 
Je vais te donner un lien car cet exo a déjà été corrigé par notre ami Coll :
![]() phisique
phisique
Enfaite la correction est un peu mal faite parce que celui qui demande a Coll ne repond pas a ces questions
Bon rapidement alors 
1. Un atome se présente sous la forme :
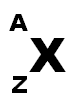
avec A nombre de masse et Z nombre de charge.
Cet atome a donc
* Z protons
* Z électrons
* (A-Z) neutrons
Si mp est la masse du proton, mn celle du neutron et me celle de l'électron,
la masse de l'atome est M = Z*mp + Z*me + (A-Z)*mn.
Dans ton exercice, il semble qu'on néglige le poids des électrons et que mp  mn
mn
donc la masse de l'atome devient M = (Z + A -Z)*mp soit M = A*mp.
Ici A = 63 et mp = 1,67x10^-27 kg
donc M = 63*1,67x10^-27 kg = 1,05x10^-25 kg.
2. Un échantillon pèse 5 mg soit 5x10^-3 kg
donc pour connaître le nombre d'atomes de l'échantillon, on divise cette masse par la masse d'un atome :
N = = 2,38x10^23 atomes
Vérifie mes calculs car j'ai fait cela rapidement. Il faut que je m'en aille. Aussi, si tu as des questions j'y répondrai + tard ou demain.
Si mes souvenirs sont exacts, on a déjà fait ce type d'exo ensemble. Il ne devrait donc ne pas avoir trop de pb  .
.


