Inscription / Connexion Nouveau Sujet
ph d'une solution
Bonjour a tous,s'il vous plait,j'aurais besoin de votre aide sur l'exercice qui suit.
La constance d'acidité du couple acide benzoïque/ion benzoate est de ka=6.3 ×10-5. On melange Va=10cm3 d'acide benzoïque de Ca=0.16mol/L à Vb=8cm3 de soude Cb=0.1mol/L . Trouver le PH de la solution obtenue.
A- 9.3 B- 7.5 C- 6.3 D- 4.2 E- 3.2
Personnellement pour trouver ce Ph,j'ai tout d'abord trouver le ph de la solution acide en faisant PH=(1/2 ×Pka)- (1/2×logCa) sachant que pka=-logKa. Puis j'ai trouver la concentration en H3O en sachant que ,[H3O+]=10-PH. enfin,j'ai trouver l'acidité totale du milieu après le melange.[H3O+]t =((CbVb) +( [H3O+].Va) )/(Vb+Va). Et enfin j'ai trouver le PH final en faisant PH=-Log[H3O+]t
Mais je ne trouve aucune aucune des reponses du QCM,donc s'il vous plait indiquer moi comment proceder,car on dirai que mq logique est fausse
Bonsoir,
Je crois que tu cherches à te "raccrocher" à tes formules toutes faites au lieu de réfléchir.
Commences par faire un diagramme des pKa : tu vas constater qu'il existe une réaction prépondérante quasi totale entre l'acide benzoïque et les ions hydroxyde. Remplis un tableau d'avancement puis, seulement à ce stade, tu pourras appliquer la formule :
Petit complément à mon message précédent : tu vas constater que tu te trouves dans un cas particulier très simple et très "classique"...
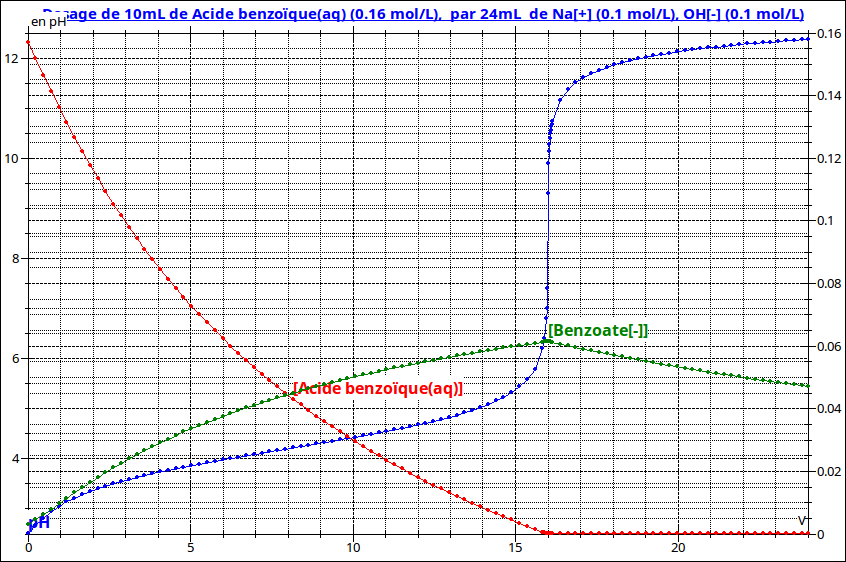
J'espère que cela pourra d'aider à comprendre : voici une simulation du dosage de l'acide benzoïque par la soude : courbe de pH en bleu, courbe de concentration en acide benzoïque en rouge, courbe de concentration en ions benzoate en vert (échelle des concentrations à droite, échelle des pH à gauche).
Regarde bien ce que devient la concentration en acide benzoïque après l'équivalence ... et bien sûr, intéresse-toi particulièrement au point correspondant à v = 8mL