Inscription / Connexion Nouveau Sujet
oxydation du fer. bilan de matière
bonjour,je voudrais de l'aide pour commencer mon exercice. je sais pas comment faire  j'ai appris a partir d'un tableau
j'ai appris a partir d'un tableau 
l'équation représentent la réaction entre le métal fer et le dioxygène est : 4Fe+3O2-> 2Fe2O3
a. quel est le réactif limitant lors de la réaction entre 2.0 mol de chaque réactif?
b. Déterminer la valeur de l'avancement maximal
c. faire la liste des espèces chimiques présentes dans le système à l'état final et déterminer leur quantité de matière.
d. quel est l'état final si 4.0 mol de fer réagissent avec 3.0 mol de dioxygène ? comment appelle-t-on cette situation particulière?
e. la reaction peut-elle se produire entre 3.0 mol de fer et 4.0 mol de dioxygène ?
Bonjour,
Bon, je vais commencer l'exo...
1)
Il y a 2,0 moles de Fe et de O2. Si on considère un état intermédiaire :
Fe : 2,0 - 4 x
O2 : 2,0 - 3 x
Donc le fer sera épuisé le premier : c'est le réactif limitant.
2)
L'avancement maximal sera donné par :
Tu peux peut-être essayer de faire le reste ?...
Tu peux aussi poser des questions s'il y a quelque chose que tu ne comprends pas...
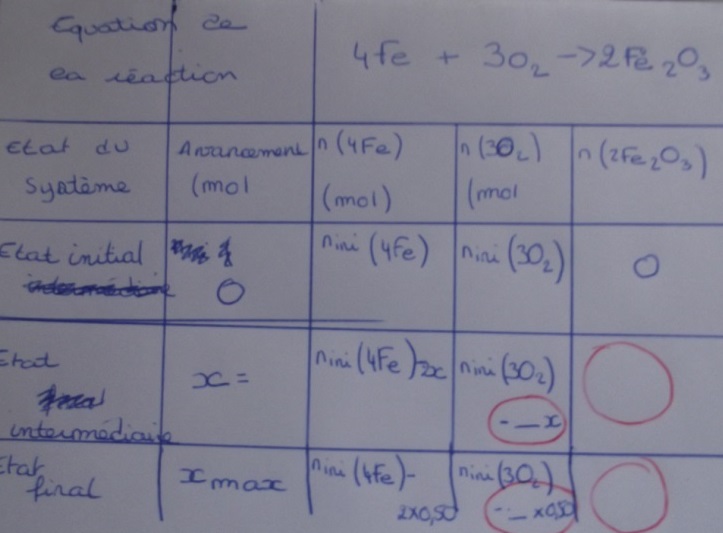
| équation de | la réaction | 4 Fe | + 3 O2 | |
| état du système | avancement | n Fe (mol) | n O2 (mol) | n Fe2O3 (mol) |
| état initial | 0 | 2,0 | 2,0 | 0 |
| état intermédiaire | x | 2,0 - 4 x | 2,0 - 3 x | 2 x |
| état final | xmax | 2,0 - 4 xmax | 2,0 - 3 xmax | 2 xmax |
On a vu que xmax = 0,50 mol (2,0 - 4 xmax = 0).
Il reste donc :
- O2 ==> 2,0 - (3
 0,50) = 0,50 mol
0,50) = 0,50 mol
- Fe2O3 ==> 2
 0,50 = 1 mol
0,50 = 1 mol
Tu vérifies tout, bien sûr...