Inscription / Connexion Nouveau Sujet
Monobromation complète.
Bonjour ,
Merci d'avance. 
On dispose dans un laboratoire de chimie du 2,2 - diméthylpentane. On désire déterminer , en présence du garçon de laboratoire , le volume de dibrome nécessaire pour réaliser la monobromation complète de 50 g de 2,2 - diméthylpentane. La masse volumique du dibrome est ρ=3120 kg.m-3
Masses molaires atomiques en g/mol : MH=1 ; MC=12 ; MO=16 ; MBr=80.
1- Écrire :
1-1) La formule brute de 2,2-dimethylpentane ;
1-2) La formule sémi développée du 2,2-dimethylpentane.
2- Écrire :
2-1) L'équation bilan de la monobromation du 2,2-dimethylpentane ;
2-2) Les formules sémi développées possibles et les noms du composé monobromé obtenu.
3- Déterminer :
3-1) La masse du produit monobromé obtenu ;
3-2) La masse du dibrome utilisée ;
3-3) Le volume de dibrome utilisé.
Réponses
1-1) la formule sémi développée du 2,2 -dimethylpentane est :
CH3
|
CH3- C - CH2 - CH2- CH3
|
CH3
D'où la formule brute du 2,2-dimethylpentane est :
C7H16
1-2) voir la réponse à la question 1-1).
2-1) La formule brute du 2,2 - diméthylpentane étant : C7H16 ; l'équation bilan de la monobromation du 2,2-dimethylpentane est :
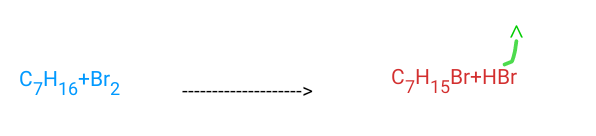
2-2) Le composé monobromé obtenu étant C7H15Br ;
Les formules sémi développées possibles et leurs noms sont :
CH2Br- CH2 - CH2 - CH2 - CH2 - CH2 - CH3
Le bromoheptane.
CH3
|
CH2Br- CH - CH2 - CH2 - CH2 - CH3
Le bromo -2 methylhexane.
CH3
|
CH2Br- C- CH2 - CH2 - CH3
|
CH3
Le bromo - 2 , 2 diméthylpentane
CH3 CH3
| |
CH2Br- C- CH2 - CH3
|
CH3
Le bromo -2,2 dimethyl-3 méthylbutane.
3-) Je ne vois pas très bien à quoi sert ρ=3120 kg.m-3..
Çà ne me dit rien
Bonjour,
Questions 1.1 , 1.2 et 2.1
OK
Question 2.2 :
Attention, la réaction de bromation ne modifie pas la chaîne carbonée.
Les différentes formules semi développées possibles ne diffèrent les unes des autres que par la position de l'atome de Brome.
3) La masse volumique sert ici à passer de la masse au volume.
Mais laquelle modifie la chaîne carbonée en principe ?
2-2) Je ne vois pas vraiment comment on fait ..
La chaîne carbonée du 2,2-diméthylpentane est :
C
|
C — C — C — C — C
|
C
La réaction de bromation ne modifie pas cette chaîne carbonée.
Les différentes molécules que tu cherches ont donc toutes, elles aussi, ce même "squelette"
Exemple :
Une des molécules que tu cherches a pour formule semi-développée :
CH3
|
CH2Br — C — CH2 — CH2 — CH3
|
CH3
Tu peux constater que cette formule a bien le même enchaînement carboné que celui du 2,2-diméthylpentane.
Il te faut maintenant trouver les autres formules semi-développées :
possibles
Ok ,
Il te faut maintenant trouver les autres formules semi-développées :
possibles
À partir de là :
CH3
|
CH2Br — C — CH2 — CH2 — CH3
|
CH3
?
Ok , je comprends..
CH3
|
CH2Br — C — CH2 — CH2 — CH3
|
CH3
Bromo - 2,2 -dimethylpentane
CH3
|
CH3— C — CHBr— CH2 — CH3
|
CH3
3-bromo-2,2diméthylpentane
CH3
|
CH3— C — CH2— CHBr — CH3
|
CH3
4-bromo - 2,2 -diméthylpentane
CH3
|
CH3— C — CH2— CH2 — CH2Br
|
CH3
5-bromo -2,2- diméthylpentane.
Pour les formules semi-développées, elles sont toutes exactes. 
Pour les noms il y a des améliorations à faire :
Formule n°1 :
1 - Bromo - 2,2 - diméthylpentane à la place de Bromo - 2,2 - diméthylpentane
Formule n° 2 :
Très bien
Pour les deux dernières formules il faut, pour satisfaire les règles de nomenclature, numéroter la chaîne principale de droite à gauche.
On obtient :
Formule n°3 :
2 - Bromo - 4,4 - diméthylpentane à la place de 4-bromo - 2,2 -diméthylpentane
Formule n°4 :
Je te laisse proposer le nom de cette molécule ( à la place de 5-bromo -2,2- diméthylpentane )
Ok ,
3-1) D'après l'énoncé ; on veut la monobromation complète de 50 g de 2,2 - diméthylpentane.
L'équation bilan demandé à la question 2-1) indique que :
La formule brute du 2,2 - diméthylpentane étant C7H16 ;
Avec mC7H16 la masse de 2,2-diméthylpentane ;
MC7H16 la masse molaire de 2,2-diméthylpentane.
On a : mC7H16 =50g
Et mC7H16 =12×7+1×16
=100 g/mol.
Donc
D'où
Or
MC7H15Br=12×7+1×15+1×80
=179 g/mol
Et par suite
On rétire
Donc la masse du composé monobromé obtenu est égal à 90 g.
3-2)
La masse volumique du dibrome est ρ=3120 kg.m-3
Comment est ce que je dois l'utiliser ?
Question 3.1 :
OK
Question 3.2 :
On calcule d'abord la masse de dibrome utilisée, puis en utilisant la définition de la masse volumique on calcule le volume de ce dibrome.
Ah d'accord .
3-2) D'après l'équation bilan à la question 2-1) ;
Avec nC7H16 et nBr2 les quantités de matières respectives de 2,2-diméthylpentane et de dibrome.
On a .
Donc
Or
Avec mBr2 la masse de dibrome et MBr2 la masse molaire de dibrome.
MBr2=80×2
=160 g/mol.
Donc
D'où .
On rétire
La masse de dibrome utilisée est égal à 80 g.
3-3) La masse de dibrome utilisée étant égal à 80 g ;
Or la masse volumique ρ(Br2)=
Avec m : la masse et V : le volume.
Or la masse volumique ρ(Br2)=3120 kg.m-3=3120kg/m³= g/m³=3120 g/L.
Donc
On rétire que
Question 3.2 :
OK
[quote]3-3) La masse de dibrome utilisée étant égal à 80 g ; Oui
Or la masse volumique ρ(Br2)= Oui
Avec m : la masse et V : le volume.
Or la masse volumique ρ(Br2)=3120 kg.m-3=3120kg/m³= g/m³=3120 g/L. Non !
C'est vrai !
Toutes mes excuses.
J'ai mal lu ta réponse (qui n'était pas très bien rédigée)
J'ai trouvé V(Br2) =80/3120 = 0,026L = 26 cm³


