Inscription / Connexion Nouveau Sujet
Molécules et interaction
Bonjour, j'ai des difficultés à résoudre un exercice. Pouvez-vous m'aider y parvenir. Merci de votre aide...
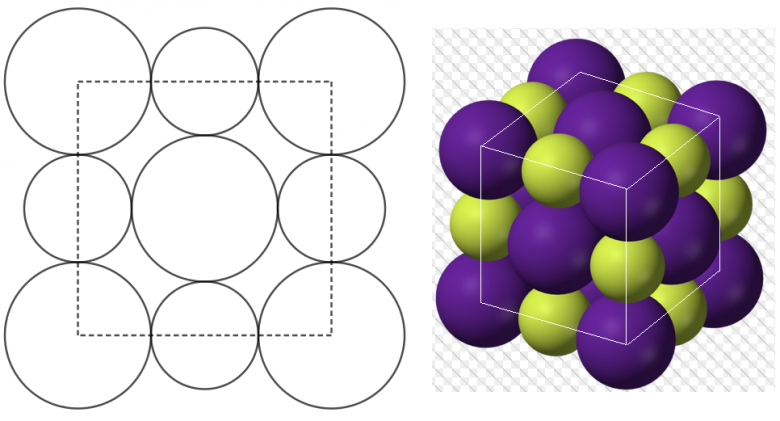
Le chlorure de potassium est un cristal ionique formé d"ions potassium K+ et ions chlorure Cl- . Sa structure cristalline et du type cubique face centrée (c.f.c) c'est-à-dire que les ions Cl - sont situés au sommet du cube et au centre de chaque face, alors que les ions K+ sont placés au milieu de chaque arête.
[img1]
1.Determinez en nm la valeur de l'arête a du cube.
2.a)Quelle est la distance d1 séparant le centre de deux ions potassium les plus proches ?
b)Indiquez la nature de l'intéraction élecrique entre deux ions potassium, a savoir attractive ou répulsive.
c)Calculez la force électrique F1 entre deux ions potassium distants d1.
3.a)Determinez la distance d2 entre un ion potassium et un ion chlorure voisin.
b)L'intéraction électrique est-elle attractive ou répulsive entre ces deux ions?
c)Deduisez-en la force électrique F2 entre ces deux ions
4.En comparant les forces au 2.c) et au 3.c) indiquez ce qui assure la stabilité du cristal.
Données:
•rayon ionique de l'ion potassium =0,133nm
•rayon ionique de l'ion chlorure =0,181nm
•e=1,6.C
•k=9.S.I.
Reponses:
1.
=0,133^2+0,181^2=0,05nm
2.a)ABCD est un cube
D'apres le theoreme de Pythagore
On en deduit que:
d1^2=
d1^2=0,1
d1=
b) attractive car ils sont de meme signe
c)F1=k×()^2/d1^2
=1,3.10^-8N
3.a)0,133+0,181=0,314nm
b)repulsive car ils sont de signes contraires
c)F2=2,3.10^-9N
4.F1/F2=5,6
A l'echelle atomique, les forces électrique ne sont pas négligeable.
La stabilité du cristal ne peut s'expliquer que par l'existence d'une interaction attractive entre les ions potassium k+ et les ions chlorure cl- qui permet la cohésion du cristal. Il s'agit de l'interaction forte.
Bonsoir,
Je te joins 2 schémas de la maille de KCl
A gauche une "vue de dessus"
A droite une "vue en 3 D"
Cel devrait t'aider à rectifier tes erreurs sur l'arête de la maille et la distance entre ions K+
J'ai déjà ces deux schemas dans mon exercice mais je n'ai pas arrivé a les joindre ici.
Je rectifie donc mes erreurs.
Distance de l'arete a= 0,6
Distance entre ions K+=d1=0,05
Non, je ne trouve pas les mêmes résultats.
Et comme tu ne détailles pas ton calcul je ne peux pas te corriger efficacement.
De plus, les résultats donnés sans unités sont faux "ipso facto".
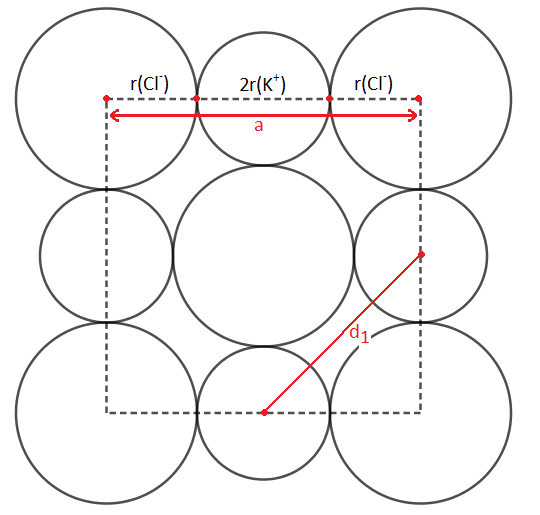
Je détaille mes calculs, et réctifie :
•Pour la distance de l'arête a, j'ai fait la somme de +
. Ce qui me ramene a mon résultat: 2×0,133+2×0,181=0,628nm
•Pour la distance d1 des ions potassium k+ les plus proches,j'ai utilisé le théoreme de Pythagore:
Soit : =
=1,28
Donc d1==1,13nm
Merci de votre confirmation...
•Pour la distance de l'arête a, j'ai fait la somme de
Ton résultat était " 0,6 " : Pour moi il était faux
En revanche 0,628 nm qui est un résultat comportant une unité et un nombre correct de chiffres significatifs est un résultat exact
Pour la distance d1 des ions potassium k+ les plus proches,j'ai utilisé le théoreme de Pythagore:
Soit :
Donc d1=
C'est la bonne méthode.
En revanche je ne sais pas ce qu'est le " 0,8 " que tu utilises dans ton calcul.
Le 0,8 cest la racine carré de la distance d1.
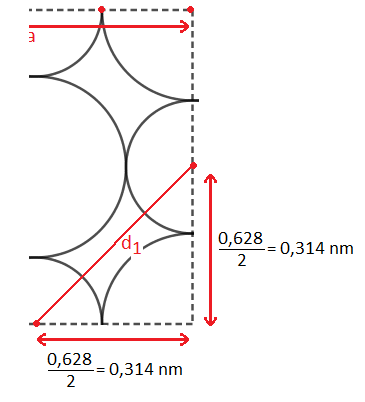
Bon, alors je ne comprends pas comment tu appliques le théorème de Pythagore.
On a un triangle rectangle isocèle dont l'hypotéhuse est " d1 " et dont les côtés de l'angle droit sont égaux à la moitié de l'arête du cube donc à 0,314 nm
(d1)² = (0,314)² + (0,314)² = 0,1972
d1 = 0,444 nm
Après vérification de mon exercice, j'ai eu l'impression d'avoir presque tout faux. J'ai donc refait l'exercice en corrigant mes erreurs. Pouvez-vous me corriger. Merci...
Reponses:
1.
=0,133^2+0,181^2=0,05nm
2.a)ABCD est un cube
D'apres le theoreme de Pythagore
On en deduit que:
d1^2=
d1^2=0,1
d1=
b) attractive car ils sont de meme signe
c)F1=k×(
=1,3.10^-8N
3.a)0,133+0,181=0,314nm
b)repulsive car ils sont de signes contraires
c)F2=2,3.10^-9N
4.F1/F2=5,6
A l'echelle atomique, les forces électrique ne sont pas négligeable.
La stabilité du cristal ne peut s'expliquer que par l'existence d'une interaction attractive entre les ions potassium k+ et les ions chlorure cl- qui permet la cohésion du cristal. Il s'agit de l'interaction forte.
Reponses:
1. a=2×0,133+2×0,181=0,628nm
2.a) (d1)² = (0,314)² + (0,314)² = 0,1972
d1 = 0,444 nm de odbugt1
b)La nature de l'interaction electrique entre deux ions potassium est repulsive car ils sont de meme signe.
c)F1=
3.a)d2=0,133+0,181=0,314nm
b)L'interaction electrique un ion potassium et un ion chlorure voisin est attractive car ils sont de signes contraire.
c)F2=
4.
A l'echelle atomique, la force F1 n'est pas negligeable devant la force F2.
La stabilité du cristal ne peut s'expliquer que par l'existence d'une interaction attractive entre les ions potassium k+ et les ions chlorure cl- qui permet la cohésion du cristal. Il s'agit de l'interaction forte.
1. a=2×0,133+2×0,181=0,628nm
OK
2.a) (d1)² = (0,314)² + (0,314)² = 0,1972
d1 = 0,444 nm de odbugt1
OK
b)La nature de l'interaction electrique entre deux ions potassium est repulsive car ils sont de meme signe.
OK
c)
Non. La distance d1 entre 2 ions K+ n'est pas égale à 3,14.10-10 m et F1 n'est donc pas égal à 2,34.10-9 N
3.a)d2=0,133+0,181=0,314nm
OK
b)L'interaction electrique un ion potassium et un ion chlorure voisin est attractive car ils sont de signes contraire.
OK
c)F2=
OK
4.
OK
A l'echelle atomique, la force F1 n'est pas negligeable devant la force F2.
La stabilité du cristal ne peut s'expliquer que par l'existence d'une interaction attractive entre les ions potassium k+ et les ions chlorure cl- qui permet la cohésion du cristal. Il s'agit de l'interaction forte.
La force attractive F2 est deux fois plus intense que la force répulsive F1, ce qui explique la stabilité de l'ensemble.
Cela n'a rien à voir avec l'interaction forte qui est une interaction nucléaire ( au sein du noyau )



