Inscription / Connexion Nouveau Sujet
Molécule - Atomes 1H, 6C, 7N et Créatine
Bonjour à tous, voici deux exercices de chimie que j'ai à faire mais je n'y arrive pas et j'aurais besoin de votre aide si ça ne vous dérange pas... pour l'exercice 1, j'ai répondu aux questions 1, 2 et 4 mais pour les questions 3, 5, 6, 7 et 8, je ne sais pas du tout ce qu'il faut mettre. Pour l'exercice 2, j'ai répondu aux trois questions mais je ne suis pas sûre du tout de mes réponses. Pourriez-vous m'aider à terminer ces deux exercices svp?
Exercice 1 – Molécule:
Données:
Masses molaires atomiques (en g.mol-1) : H : 1,0 ; C : 12,0 ; O : 16,0 ; N : 14,0
Constante d'Avogrado : NA = 6, 02.1023 mol-1.
Questions:
1. Déterminer la structure électronique des atomes 1H, 6C, 7N.
Ma réponse: La structure électronique des atomes 1H, 6C et 7N sont:
→ Pour l'atome d'hydrogène, sa structure électronique est (K)1.
→ Pour l'atome de carbone, sa structure électronique est (K)2(L)4.
→ Pour l'atome d'azote, sa structure électronique est (K)2(L)5.
2. Combien de liaisons covalentes chaque atome doit-il former pour satisfaire la règle du duet ou de l'octet?
Ma réponse: Pour satisfaire la règle de l'octet, chaque atome doit engager le nombre d'électrons suivant: L'atome H doit engager 1 électron, l'atome C doit en engager 4 et l'atome N doit en engager 3.
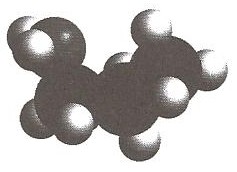
3. Ecrire la formule développée de la molécule ci-contre (voir image).
 Là j'ai jamais compris comment il fallait faire. =\
Là j'ai jamais compris comment il fallait faire. =\
4. Rappeler la définition de deux isomères.
Ma réponse: Deux isomères sont deux composés qui ont la même formule brute mais dont les molécules sont différentes.
5. Ecrire la formule développée (ou semi-développée) des 3 autres isomères non cycliques de la molécule ci-contre. (voir image)
 Là non plus, je n'ai pas compris comment faire.
Là non plus, je n'ai pas compris comment faire.
6. Calculer la masse molaire de cette molécule.
Je ne sais pas.
7. En déduire la masse de 6,5.10-2 mol de ce composé.
Je ne sais pas.
8. Combien de molécules sont contenues dans cet échantillon?
Je ne sais pas.
Exercice 2
** exercice effacé **
Merci d'avance 
Edit Coll : merci de respecter la FAQ, un problème = un topic 
![]()
bonjour,
pour la question 3 il me faudrait l'image !
pour la question 5 je pense qu'il faut d'abord calculer la masse de la molécule :
en faisant (par rapport au nombre d'atome) 6x m(C) + 1 x m(H) etc
ex ici : 6x 12.0 + 1x 1.0 etc
et ensuite tu utilise la relation avec la constante d'Avogadro :
M = na/ n
mais il me faut le nom de la molécule (la formule brute).
pour la question 7 tu connais la qq de matière c'est à dire 6.5.10-2 (n)
et tu remplace par M (que tu auras trouvé précédemment)
donc tu auras M = Na / N (il te suffit de remplacer les valeurs et c'est bon !.
voilà bonne soirée.
Bonjour j'avais chargé la photo sur mon topic mais comme le 2e exercice a été déplacé, la photo est partie avec comme lorsqu'on charge une photo sur un topic, elle se retrouve automatiquement tout en-bas ! Je la re-scane et je vous la remet sur le topic !
Merci pour la suite 


 votre niveau
votre niveau site
site