Inscription / Connexion Nouveau Sujet
Molecule
Bonjour, j'aimerais avoir votre avis pour une question d'exercice: on me demande de corrigé la molecule suivante pour formule de Lewis.
H
|
H- C--C--O--H
| |
H H
Alors, j'ai essayer des tonne de combinaisons mais je parviens pas a etablire le bon nombre de liaison par atome, donc j'ai fini par changer la formule brute et je suis passer de 5 hydrogene a 4, pour avoir
H
|
H-C--C~O. AVEC 2DNL pour O
| |
H. H
Avec ~ : double liaison.
Je peux avoir votre avis,on me demande aussi de justifier avec la regle de l'octet j'ai donc dis que C forme 4 liaison pour octet, oxygene en forme 2 pour octet et enfin H 1pour duet.
Merci beaucoup !
Bonjour mkask :
Ta première formule est fausse ; il manque un hydrogène soit = CH3-CH2-O-H .
Ta deuxième correspond au produit d'oxydation soit CH3-CH=O .
Bonnes salutations .
Bonjour,c'est mon devoir commun de ce matin et je vous assure que c'est ce qui est marqué.
J'ai passé une demi heure a essayer d'arranger la molecule en vain, mais puisque la consigne etais "corriger la molecule" et non pas "corriger la formule developpé"je me suis dis que peux etre fallait-il modifier la formule brute, mais c'est bien C2H5O qui etais representé de cette maniere !
Ca m'etonne pas qu'il se soit trompé mes profs..
Je leur ai fait remarqué une autre erreur dans un autre exercice donc bon..
Ducoup c'est pas possible de repondre a la reponse ?
En gros je sais pas si il fallait justement changer la premeire formule semi developpé en enlevant un H et former une double liaison ou bien rajouter un H sur le C.
Vous avez une idee ?
Bonjour, j'aimerais avoir votre avis pour une question d'exercice: on me demande de corrigé la molecule suivante pour formule de Lewis.
H
|
H- C--C--O--H
| |
H H
Alors, j'ai essayer des tonne de combinaisons mais je parviens pas a etablire le bon nombre de liaison par atome, donc j'ai fini par changer la formule brute et je suis passer de 5 hydrogene a 4, pour avoir
H
|
H-C--C~O. AVEC 2DNL pour O
| |
H. H
Avec ~ : double liaison.
Je peux avoir votre avis,on me demande aussi de justifier avec la regle de l'octet j'ai donc dis que C forme 4 liaison pour octet, oxygene en forme 2 pour octet et enfin H 1pour duet.
Merci beaucoup !
*** message déplacé ***
Lorsqu'il disent de corrigé la molécule, je ne sais pas si c'est seulement la formule développé qui est mal arrangé ou la formule brute qui n'existe pas carrément !
Ducoup j'ai donc fait ca en gros..
H
|
H-C--C=O. AVEC 2DNL pour O
| |
H. H
*** message déplacé ***
Bonjour.
Inutile de faire de double post, vous avez déjà posé cette question dans le topic intitulé "molécule".
Il n'existe aucune molécule de formule brute C2H5O.
La seule structure approchante correspond à l'ion éthanolate dont la formule s'écrit : C2H5O-.
L'image ci-dessous en donne la représentation de Lewis.
Les tirets rouges correspondent au signe moins - ; ils signalent la charge négative de l'ion ; les tirets noirs correspondent à des doublets électroniques liants ou non liants.
L'autre option est qu'il s'agit d'une formule brute de type C2H4O ; cette formule qui conduit à l'éthanal, vous a été proposée dans le topic "molécule".
Cet exercice a été mal posé, interrogez votre professeur pour savoir ce qu'il attend précisément.
Au revoir.
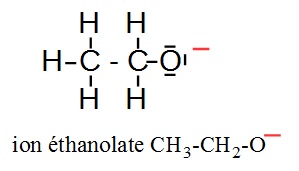
*** message déplacé ***
Salut,
Ok mais comment aurais-je pus savoir si je devais ajouter un hydrogène ou en enlevé 1 ??
C'est quand même fou de n'avoir que si peu d'infos pour le résoudre, vous trouvez pas ?
Bonsoir,
mille excuses, je commençais sincèrement a croire que mon topic beugé étant donné que tout sujet recevais réponse sauf celui la qui n'étais qu'une question !
Désolé, je connais le règlement ca ne se reproduira plus !
Bonne soirée.
*** message déplacé ***



 ) :
) :

