Inscription / Connexion Nouveau Sujet
Molécule
Bonsoir,
C2H5N
Formule de Lewis :
Est-ce juste svp ?
H H
| |
H - C - C ---N|
| |
H H
--- = 3 traits horizontaux l'un sur l'autre
Il me semble que plusieurs sont possibles, par exemple (piqué sur wiki) :
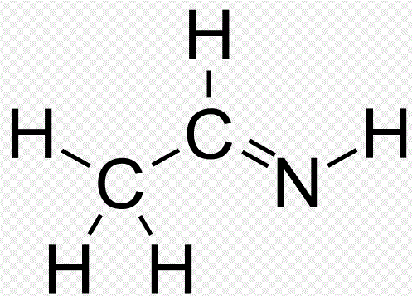
Mais, il y en aurait d'autres que je ne serais pas étonné.
Cependant, comme je suis nul en chimie, il vaut mieux attendre l'avis d'autres.

Bonjour
La formule de Lewis que tu proposes est fausse :
si tu imagines 3 liaisons covalence entre C et N et un doublet non liant sur N, la règle de l'octet est bien vérifiée pour N mais elle ne l'est pas pour C : (6 doublets de liaisons) !
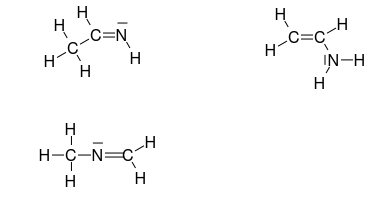
Plusieurs isomères existent effectivement. Celui signalé ci-dessus mais aussi :
CH3-CH=N-H
J'ai posté trop vite : la molécule que je viens de proposer est la même qu'au dessus : il faut lire :
CH3-N=CH2
JP j'ai une question à propos du modèle de Lewis que tu as proposé
Pourquoi les doublets non liants ne sont pas représentes autour de l'atome N ?
Pourquoi les doublets non liants ne sont pas représentes autour de l'atome N ?
C'est un simple oubli. Le doublet non liant de N est bien présent sur la représentation de la même molécule que j'ai postée à 11h31.
Pour compléter les messages précédents : voici les formules développées de trois isomères possibles : les deux déjà signalés et un troisième. Je te laisse vérifier que, dans les trois cas, la règle de l'octet est vérifiée pour les atomes C et N et la règle du duet vérifiée pour l'atome H.
Merci de vos réponses 
J'ai un contrôle la semaine prochaine sur les deux chapitres suivants :
- Géométrie des molécules
- Molécules organiques et couleur
Niveau 1ère S.
Quels sont vos conseils/fiche ?
Possèdes-tu un livre de chimie ? Si oui, tu y trouveras un cours détaillé, des résumés en fin de chapitre et surtout, des exercices te permettant de t'entraîner. Si certains de ces exercices ne sont pas corrigés dans le livre, tu peux demander de l'aide sur ce forum.
Bonjour
Il s'agit bien sûr de la même molécule. Cependant, l'usage est de nommé d'abord l'élément le plus électropositif, celui qui a le plus tendance à se ioniser positivement. Comme H a plutôt (pas toujours...) tendance à se ioniser positivement en H+ alors que S a plutôt tendance à se ioniser en S2-, on préfère l'écriture H2S plutôt que SH2. Tu as la même règle pour HCl, H2O...


