Inscription / Connexion Nouveau Sujet
Masses des composés après réaction
Bonjour!
Voici mon problème :
" soit la réaction : C6H8O7 + NaHCO3 -----> C6H7O7Na + CO2 + H2O
On mélange une solution de 0,25 L de NaHCO3 de concentration 150g/L avec 0,25 L d'une solution de C6H8O7 de concentration 1,35 mol/L.
Calculez les masses des différents composés présents à la fin de la réaction."
En fait je ne sais pas vraiment pas où commencer et comment m'y prendre.. :/
Merci d'avance
Bonjour,
A partir de la donnée :
" une solution de 0,25 L de NaHCO3 de concentration 150g/L "
il te faut calculer la masse ( en grammes ) puis la quantité de matière (en mol) de NaHCO3 présents dans cette solution.
Puis à partir de la donnée :
" 0,25 L d'une solution de C6H8O7 de concentration 1,35 mol/L. "
Tu calcules la quantité de matière (en mol) de C6H8O7 présents dans cette deuxième solution.
A partir des deux quantités de matière obtenues (en mol) tu recherches le réactif limitant et le réactif en excès.
Tu pourras alors en déduire les quantités de matière (en mol) puis les masses des différents composés présents à la fin de la réaction.
Remarque : Tu auras besoin des masses molaires atomiques des éléments Na, H, C, O
Pour ce qui est de NaHCO3 :
La concentration massique est de 150g/L , donc sa concentration molaire volumique vaut : "Concentration massique / masse molaire de NAHCO3" ce qui est égal à 1,79 mol/L .
Seulement on a 0,25 L dans notre solution, ce qui veut dire qu'on a 37,5g / 0,25L
et 0,45mol/0,25L
Pour ce qui est de C6H8O7 :
N'ayant que 0,25 L on a donc 0,34 mol/0,25L
Le réactif en excès est donc NaHCO3
Mais déjà si je ne me suis pas trompée, là je bloque parce que je n'arrive pas à faire le lien et voir comment avec ça je vais trouver les masses des composés..
Tu es sur la bonne voie, mais ce que tu écris est un peu "brouillon".
(*) On remarque que tous les coefficients stoechiométriques sont égaux à 1.
Pour NaHCO3 avant réaction :
1Litre de solution contient 150g de NaHCO3 donc 0,25L en contiennent 0,25*150 = 37,5g
Ces 37,5g représentent 37,5/84 = 0,4464 mol de NaHCO3
Pour C6H8O7 avant réaction:
1 litre de solution contient 1,35 mol de C6H8O7 donc 0,25L en contiennent 0,25*1,35 = 0,3375 mol
Réactif limitant : 0,3375 mol < 0,4464 mol
C6H8O7 disparait entièrement. C'est le réactif limitant
Réactif en excès : Il va rester un excès de 0,4464 - 0,3375 = 0,1089 mol de NaHCO3
Produits formés :
Il se forme autant de moles de C6H7O7Na, de CO2, de H2O qu'il disparait de réactif limitant.
Voir la remarque (*)
Donc il se forme 0,3375 moles de C6H7O7Na, 0,3375 moles de CO2 et 0,3375 moles de H2O
Composition du mélange final :
Il est donc formé de 0,3375 moles de C6H7O7Na, 0,3375 moles de CO2, 0,3375 moles de H2O et d'un excès de 0,1089 mol de NaHCO3
Il suffit maintenant de calculer les masses correspondantes à ces quantités de matières pour répondre à la question posée
Aah je comprends beaucoup mieux , je ne sais pas pourquoi ça ne m'est pas venu plus facilement..
Donc si je veux résumer "avec mes mots" les étapes pour répondre à ce type d'exercices , c'est à peu près :
1.trouver le nombre de moles correspondantes aux réactifs dans la solution
2. Regarder dans quel rapport réagissent les substances dans l'équation de base
3. Dans le cas présent, en déduire qu'un réactif est en excès et calculer combien il y a en trop
4. Déduire le nombre de moles qu'il y a du côté des produits en se basant sur la quantité du réactif limitant
5. Calculer les masses qui correspondent à ces quantités de matières.
J'en profite pour demander si c'est un problème si je poste souvent des problèmes sur le forum? (Disons qu'ayant bientôt mes examens de science c'est une période où je dois être sur d'avoir tout compris mais je ne veux pas qu'on pense que je spamme ou demande aux gens de faire mes devoirs à ma place..)
J'en profite pour demander si c'est un problème si je poste souvent des problèmes sur le forum? (Disons qu'ayant bientôt mes examens de science c'est une période où je dois être sur d'avoir tout compris mais je ne veux pas qu'on pense que je spamme ou demande aux gens de faire mes devoirs à ma place..)
Non, cela ne pose à ma connaissance aucun problème.
Tu as bien compris la démarche de cet exercice.
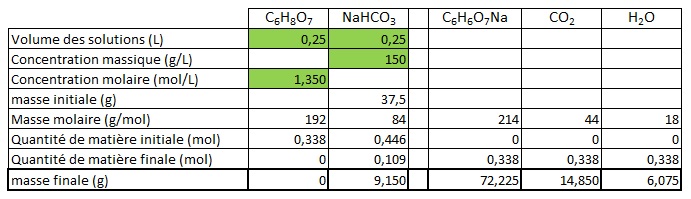
Voici un résumé sous forme de tableau.
Les cases vertes correspondent à des données de l'énoncé. Les autres cases sont déduites ou calculées.