Inscription / Connexion Nouveau Sujet
maille de la carboglace
Bonjour,
Je bloque sur un exercice:
La carboglace, ou CO2solide, a une structure cfc, les n?uds du réseau étant occupés par les molécules de dioxyde de carbone.
La masse molaire du dioxyde de carbone est M=44 g.mol-1 pour une densité d de 1,56. 1)Calculer le paramètre cristallin a et en déduire la distance d entre les carbones de deux molécules voisines. Comparer d à la longueur de la liaison C-?O de la molécule de CO2: l= 0, 12 nm. Expliquer la différence.
Alors pour calculer a, avec la densité je trouve la masse volumique de CO2 puis avec la masse molaire je trouve le volume d'une mole (28.2mL) puis d'une molécule (4.685*10^-23 mL)
J'arrive ainsi à R=224pm sauf erreur et ainsi a=634 pm
Mais comment relier ça avec la distance entre les carbones ?
Cordialement
Bonjour,
Si je suis bien ton raisonnement tu es passé du volume molaire de la neige carbonique (en mL/mol) au volume individuel d'une molécule (en mL) par l'intermédiaire de la constante d'Avogadro.
Ton calcul serait correct s'il n'y avait aucun vide entre les molécules ce qui n'est pas le cas.
Autrement dit : Le volume occupé par un ensemble de molécules n'est pas la somme des volumes des molécules.
De la même manière le volume occupé par un verre de grains de riz n'est pas égal à la somme des volumes de ces grains.
Il te faut tenir compte de la structure cfc de la neige carbonique.
ah oui effectivement c'est n'importe quoi 
Donc on a la masse volumique du CO2 p=1.56 g/cm3 mais comme on est dans une maille la masse est de 4*M/Na car 4 molécules dans une maille Cfc
la masse volumique est 4*M/(Na*a^3) =1.56 et donc de cette manière je peux isoler a Puis trouver R avec la formule pour la maille cfc ?
SI c'est bien ça, comment ensuite relier cette valeur à la distance entre les carbones ? Il y a une formule ?
Commençons par répondre à la question concernant le paramètre de maille " a "
On a bien la relation :
soit
Quelle valeur obtiens tu pour a ?
OK
Un calcul (assez approximatif car on ne connait pas le rayon d'un atome d'oxygène) te montrera que les molécules de CO2 ( qui sont linéaires ) ne s'alignent pas bout à bout sur une arête.
En fait, elles s'orientent selon des directions plus ou moins parallèles aux diagonales du motif de la maille.
Voir figure piquée sur le net.
Très bien. Mais justement si ils ne sont pas alignés alors la distance entre deux atomes de carbone n'est pas de 2*r?
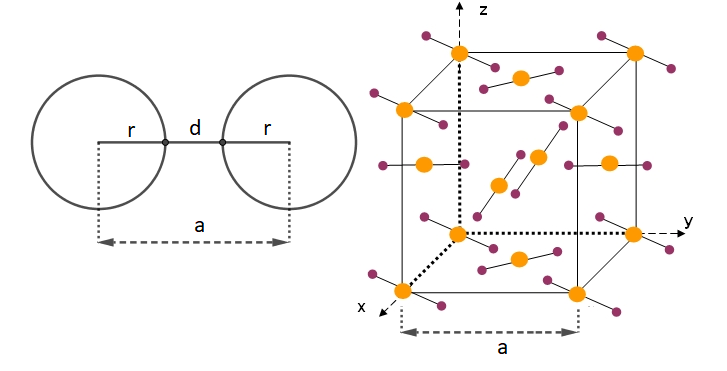
Effectivement, sur une arête du motif les atomes de carbone ne sont pas en contact donc la distance de centre à centre est supérieure à 2r
d'accord c'est donc la que je ne comprend plus  On dit juste que c'est supérieur à 2r mais sans calculer la valeur exacte ? Parce que je dois ensuite comparer à l la longueur de la liaison C=O
On dit juste que c'est supérieur à 2r mais sans calculer la valeur exacte ? Parce que je dois ensuite comparer à l la longueur de la liaison C=O
arête du motif : a = 572 pm
rayon d'une atome de C : r = 202pm
Distance entre deux atomes de C sur une arête : d = a - 2r = 168 pm
Longueur de 2 liaisons C = O : 120 * 2 = 240 pm
Bonjour, je suis en train de travailler sur la structure du co2 solide d'abord je voulais savoir si vous pensez que le co2 se cristallise avec la meme structure a n'importe quelle condition ( temperature et pression) se qui pourrait faire varier la distance entre les deux carbones.
Et aussi dans le calcul vous avez dit que la distance était supérieur à 2r mais pourquoi on fait moins 2r et pas plus ?
Merci par avance de votre réponse et je suis aussi à l'affut d'articles ou livre qui parlerait de CO2 solide si vous en connaissez.
A ma connaissance la carboglace cristallise uniquement en CFC
Je voulais dire que la distance entre les centres des atomes de carbone est supérieure à 2r donc que les atomes de carbone ne sont pas en contact.
r + d + r = a
d = a - 2r