Inscription / Connexion Nouveau Sujet
Lumière d'un atome
Bonjour, j'ai une activité de physique à préparer mais deux questions me posent problème .
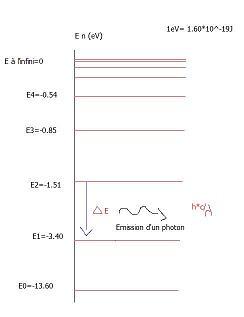
Les raies observées sur le spectre correspondent à des transitions qui se font vers le niveau d'énergie E1=-3.40eV
1)Calculer le quantum d'énergie correspondant à la radiation de longueur d'onde 486nm. (cette question je l'ai faite et j'ai trouvé 4,092259259x10(-19)
2)En déduire la valeur du niveau d'énergie initial? (cette question je ne comprend pas, c'est le niveau d'energie initial.
3)Reproduire le diagramme et symboliser cette transition par une flèche ?
je n'ai pas réussi à trouver le même spectre d'émission d'hydrogène que celui de mon livre .
Merci beaucoup.
Bonjour,
Comme tu le sais, un résultat sans son unité ne veut rien dire en physique.
Quelle est donc, avec l'unité correcte, ta réponse à la première question ?

Oui.
1) Le quantum d'énergie des photons pour une raie de longueur d'onde 486 nm vaut bien environ 4,093.10-19 J
Pour pouvoir faire la question 2 (dans laquelle les niveaux d'energie sont en électron-volts) il faut convertir cette valeur en eV

Oui, c'est mieux (  ) indispensable avec l'unité !
) indispensable avec l'unité !
En passant d'un niveau d'énergie (à déterminer) au niveau inférieur de -3,40 eV l'électron a perdu environ 2,56 eV
Cette énergie est celle du photon dont la longueur d'onde vaut 486 nm
De quel niveau d'énergie l'électron est-il parti ? (l'énoncé dit "le niveau initial d'énergie")

Relis bien ce que j'ai écrit à 18 h 44
L'électron se trouve sur un niveau d'énergie (E2 ? E3 ? E4 ? ... )
Il change de niveau pour se retrouver sur le niveau E1 où son énergie vaut -3,40 eV
Tu sais qu'il a ainsi perdu environ 2,56 eV
Quelle était son énergie de départ ? Et donc, de quel niveau est-il parti ?

ah okk
c'est E3 parceque quand on soustrait E3 et E1 on trouve 2,55 donc le niveau initiale c'est 2,55ev
Attention à la rédaction !
Le niveau initial était le niveau E3 dont l'énergie vaut environ -0,85 eV
Donc, pour la dernière question tu sais que la flèche à tracer n'est pas celle du dessin que tu as posté (entre E2 et E1) mais que c'est une flèche entre E3 et E1 avec  E
E  2,55 eV
2,55 eV



