Inscription / Connexion Nouveau Sujet
Loi De Boyle-Mariotte
Bonjour, j'ai un exercice que je n'ai pas compris. pouuvez vous m'aider svp
Afin de vérifier la loi de Boyle-Mariotte, on relie une seringue à un capteur de pression absolu convenablement étalonné. En agissant sur le piston de la seringue, on fait varier le volume de l'air qu'elle contient. On relève alors les valeurs de pression P pour différentes valeurs de volume V. la température de l'air contenu dans la seringue demaure constante et égale à 20°C tout au long de l'experience. Les résultats obtenus sont reportés dans le tableau suivant.
V(ml) 20 30 40 50 60 70 80 90 100
P(hPa) 2559 1705 1279 1023 853 731 639 568 512
(c'est un tableau)
1. Recopier le tableau en exprimant les grandeurs dans les unités du système international. Ajouter une nouvelle ligne indiquant les valeurs de l'inverse 1/V (en m^-3) du volume.
2.Sur un graphique, tracer la courbe représentant P en fonction de 1/V.
3a.La loi de boyle-Mariotte indique que le produit PV d'un gaz est égal à une constante pour une température et un quantité de matière de gaz données. Les valeurs expérimentales obtenues vérifient-elles cette loi?
b. Déterminer la valeur de la constante en Pa.m^-3.
J'ai réussi à faire la a) mais le reste non :S
Bonjour,
Tu as trouvé la réponse à la première question dans un précédent topic : 
![]() La loi de Boyle-Mariotte
La loi de Boyle-Mariotte
Qu'as-tu fait ensuite ?
Le topic dont j'ai mis le lien explique ce qu'il convient de faire aux dernières questions.
A noter que l'unité de la constante n'est pas correct. Cette constante s'exprimera en Pa.m3

Oui tout à fait ! 
J'ai pas compris à la question 1) pour Ajouter une nouvelle ligne indiquant les valeurs de l'inverse 1/V (en m^-3) du volume. On ajoute une seul ligne en plus de V(mL) , P(hPa) ,V(m3) et encore une ligne V(m-3) ? Ou seulement une ligne des deux ? Et pour la question 2 , pour tracer le courbe on place la Pression P (hPa) en fonction de quoi le volume en m3 ou le volume en m-3 merci de votre aide 
On te demande un tableau de trois lignes :
. V, le volume dans l'unité du SI
. P, la pression dans l'unité du SI
. 1/V l'inverse du volume, dans l'inverse de l'unité du SI de volume
Quelle est l'unité SI de volume ?
Quelle est l'unité SI de pression ?

J'ai beaucoup de mal avec se chapitre de Physique :/ je ne comprend pas l'unité SI ? sa veut dire quoi ? :/ parce-que déjà l'unité du volume ici est en mL et l'unité de la Pression (hPa) c'est sa ?
Merci de votre aide 
Le SI : le système international d'unités
. l'unité de longueur est le mètre (symbole m)
. l'unité de masse est le kilogramme (symbole kg)
. l'unité de temps est la seconde (symbole s)
. etc.
Dans ce système quelles sont les unités de volume et de pression ?

Ah d'accord oui je vois !! 
Donc ici dans le tableau de l'exercice y a ecrit V ( mL) P (hPa) mais ici pour exprimer les grandeurs du SI le volume en mL il faut le convertir en m3 non ? et la Pression on la laisse en (hPa) ?

Oui, il faut convertir les volumes en mètres cubes (m3)
Je pense qu'il serait mieux de convertir les pressions en pascals (Pa)
| Volume, V (m3) | |||||||||
| Inverse du volume, 1/V (m-3) | |||||||||
| Pression, P (Pa) |

D'acc donc je complète c'est trois lignes et c'est la questions 1)  donc j'essaye de les completer pouvez vous me corriger silvouplait . J'ai beaucoup de mal avec les conversions :/
donc j'essaye de les completer pouvez vous me corriger silvouplait . J'ai beaucoup de mal avec les conversions :/
20 mL -> 20.10^-6 m cube
30 -> 30.10^-6 m cube
40-> 40.10^-6
...etc ?
mais par conte pour les m-3 comment je fait ? :/
et pareil pour les Pascal :/
Silvouplait merci 
Oui, c'est bien commencé :
| Volume, V (m3) | 20.10-6 | 30.10-6 | 40.10-6 | 50.10-6 | 60.10-6 | 70.10-6 | 80.10-6 | 90.10-6 | 100.10-6 |
| Inverse du volume, 1/V (m-3) | |||||||||
| Pression, P (Pa) |
Pour 1/V il suffit de prendre l'inverse...
Un hectomètre, c'est cent mètres
hecto- est le préfixe qui signifie 100
1 hPa = 100 Pa

D'accord  merci
merci 
J'arrive pas à compléter un tableau dans un topic désoler 
Euh donc je prend l'inverse de 20.10-6 pour le premier mais sa donne euuuhhhhh comment je procède Svp ?
Mais par la suite quand il nous demande de tracer la courbe représentant P en fonction de 1/V comment on fait pour placer les points 1/V sachant que les résultats sont donner sous forme scientifique donc : V(m^-3) pour V(mL) 20 -> 50.10^3 -> 50000
30-> 30.10^-6->3,33.10^-8 et sa donne pas de valeur exacte donc comment on fait pour placer c'est point dans la courbe svp :s ?
merci 
*** message déplacé ***
Mais par la suite quand il nous demande de tracer la courbe représentant P en fonction de 1/V comment on fait pour placer les points 1/V sachant que les résultats sont donner sous forme scientifique donc : V(m^-3) pour V(mL) 20 -> 50.10^3 -> 50000
30-> 30.10^-6->3,33.10^-8 et sa donne pas de valeur exacte donc comment on fait pour placer c'est point dans la courbe svp :s ?
merci 
Cela n'avance pas très vite...
| Volume, V (m3) | 20.10-6 | 30.10-6 | 40.10-6 | 50.10-6 | 60.10-6 | 70.10-6 | 80.10-6 | 90.10-6 | 100.10-6 |
| Inverse du volume, 1/V (m-3) | 50 000 | ||||||||
| Pression, P (Pa) |
Que vaut l'inverse de 30.10-6 ? Ce n'est pas ce que tu proposes...
Et que vaut 2 559 hPa en pascals ?

Oui désoler ..
Euh bah mais enfaite je comprend pas comment on fait pour trouver l'inverse ont fait : pour le premier 1/20*10^-6 ? Le second 1/30*10^-6 ? ...etc ?
Et 2 559 hPa -> 255 900 Pa ? :S
Mais oui ! L'inverse de x c'est 1/x
L'inverse de 30.10-6 c'est 1/(30.10-6)  33 333
33 333
________________
1 hPa = 100 Pa
2 559 hPa = 255 900 Pa
donc
| Volume, V (m3) | 20.10-6 | 30.10-6 | 40.10-6 | 50.10-6 | 60.10-6 | 70.10-6 | 80.10-6 | 90.10-6 | 100.10-6 |
| Inverse du volume, 1/V (m-3) | 50 000 | 33 333 | |||||||
| Pression, P (Pa) | 255 900 |
Donne-moi toutes les valeurs (je ferai le tableau)

D'acc Merci 
Inverse du volume , 1/V (m^-3 ) 50 000 33 333 25 000 20 000  14 285 12 500
14 285 12 500  11 111 10 000
11 111 10 000
Pression 255 900 :: 170 500 :: 127 900::102 300::85 300::73 100:63 900::56 800:: 51 200::
| Volume, V (m3) | 20.10-6 | 30.10-6 | 40.10-6 | 50.10-6 | 60.10-6 | 70.10-6 | 80.10-6 | 90.10-6 | 100.10-6 |
| Inverse du volume, 1/V (m-3) | 50 000 | 33 333 | 25 000 | 20 000 | 16 667 | 14 286 | 12 500 | 11 111 | 10 000 |
| Pression, P (Pa) | 255 900 | 170 500 | 127 900 | 102 300 | 85 300 | 73 100 | 63 900 | 56 800 | 51 200 |
D'où le graphique :
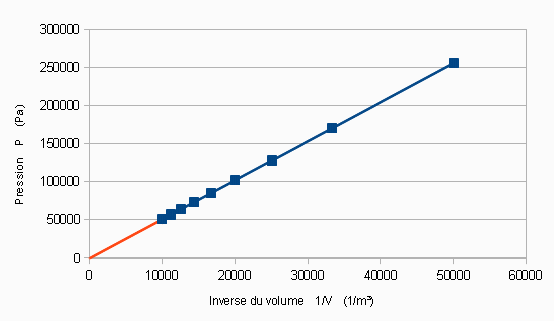
A toi !

Merci beaucoup ! Donc la pour la dernière question b) Déterminer la valeur de la constante en Pa.m-3
Je procède comme sa : a= yA - yB/xA-xB= ?
Après je remplace ?
Comme cela est bien dit dans l'autre topic...
N'oublie pas l'unité, sinon je ne pourrai pas répondre.



