Inscription / Connexion Nouveau Sujet
Les piles
Bonsoir cher tous !
Svp dans Une pile.
Déterminer la variation en masse des électrodes constituant Les pôles négatifs et positifs revient à calculer quoi ?
Dans mon cas.. On ne m'a renseigné que sur la concentration molaire des solutions et sur le potentiel standard.
Merci
Bonjour.
On ne m'a renseigné que sur la concentration molaire des solutions et sur le potentiel standard.
Postez un énoncé COMPLET.
Je dois me déconnecter maintenant, tout relayeur est le bienvenu !
OK. Voici l'énoncé
On dispose de deux solutions aqueuses dont l'une est le sulfate de nickel et l'autre le nitrate d'argent. Toutes de concentration molaire 1mol/l. Et deux lames métalliques dont l'une couples redox ag+/ag et Ni 2+/Ni. On se munit de deux solutions et des deux métaux précédents ,d'un papier filtre imbibé de nitrate de potassium et d'un Volmètre.
1)Determiner la variation en masse des électrodes constituant Les pôles négatifs et positifs de cette pile et donner Sa représentation conventionnelle.
E*(ag+/ag)=0.8v et E*(Ni2+/Ni) =-0.23v.Q=200c et 1F=96500C
Bonjour,
Si tu ne disposes que de ce texte en guise d'énoncé, il te faut retourner voir ton professeur et lui demander un énoncé, un vrai !
En attendant ....
Puisque E0(Ag+/Ag) > E0(Ni2+/Ni) la demi-pile Argent sera le pôle positif et l'autre demi-pile le pôle négatif de la pile.
Cette simple constatation permet ( à condition de connaître le cours !) de donner la représentation conventionnelle de la pile, de connaître le sens du courant électrique de la pile quand elle débite dans un circuit extérieur, d'en déduire le sens de circulation des électrons dans ce circuit extérieur, ainsi éventuellement le sens de déplacement des porteurs de charge à l'intérieur de la pile.
On peut alors en déduire les équations des demi-réactions pour chaque demi-pile puis l'équation de la réaction globale qui régit le fonctionnement de la pile.
Pas mal pour un début .... et très utile pour la suite !
OK. Sauf que c'est une épreuve que je traite. Et c'est la question pour déterminer la variation de masse qui me dérange.
À défaut peux tu au moins me donner la formule à utiliser ?
Les "formules" me font penser à un magicien qui sortirait de son chapeau en disant "Abracadabra" la solution miracle qu'on appliquerait en évitant surtout de réfléchir.
N'étant pas magicien, je n'ai pas de "formule". 
Et toi peux tu "au moins" écrire les équations des demi-réactions qui ont lieu dans chaque demi-pile ?
Ce serait bien, parce que à partir de cela je pourrais t'expliquer sans la moindre "formule" comment calculer la variation de masse qui a lieu à chaque électrode. 
Et en attendant voici quelques réponses à ce que j'évoquais précédemment :
a) Le pôle + de la pile étant sur la demi-pile Argent, le courant électrique va aller dans le circuit extérieur de cette demi-pile vers l'autre. ( Ça c'est du cours.)
b) Les électrons circulent (toujours dans le circuit extérieur) en sens inverse : Ils quittent la demi-pile Nickel et vont vers la demi-pile Argent.( Ça aussi c'est du cours.)
Ces considérations de sens du courant et des électrons peuvent t'être utiles pour écrire correctement les
demi - équations qui sont au cœur de cet exercice.
Pas magicien donc ...
Mais je sais ce qui se produit dans une pile.
Ci-dessous un schéma avec 2 phrases explicatives.
Chaque phrase est la traduction en langue naturelle de la demi-équation correspondante.
Peux tu écrire ces demi équations ?
a) Côté Nickel (départ de deux électrons)
b) Côté Argent (arrivée de deux électrons)
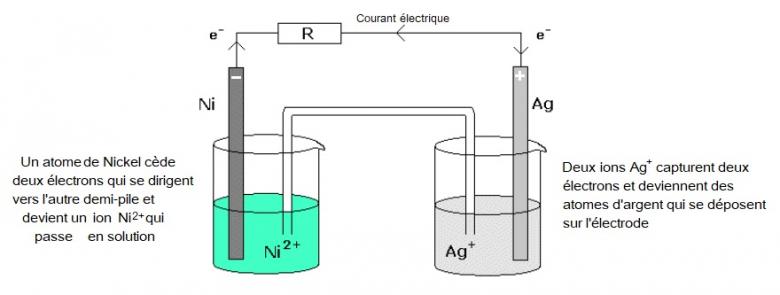
À l'Électrode de nickel se produit une réaction d'oxydation
Ni==Ni2+ + 2e-
Électrode d'agent
Ag+ +e-==Ag
Désolé pour l'écriture car je n'ai pas les applications me permettant de l'écrire normalement
Une seule chose à la fois.
On reparlera de l'électroneutralité plus tard.
Tes 1/2 équations sont exactes.
Celle concernant le Nickel montre que chaque fois qu'il circule 2 moles d'électrons, il disparait en même temps 1 mole d'atomes de Nickel (qui sont prélevés sur l'électrode).
Or il se trouve que tu peux calculer le nombre de moles d'électrons qui a circulé car tu sais qu'il a circulé une charge de Q = 200C et tu sais (je suppose) qu'une mole d'électrons porte une charge de 1Faraday soit de 96500C
Tu as donc les outils nécessaires pour calculer le nombre de moles d'électrons transportés, puis (en divisant par 2) le nombre de moles d'atomes de Nickel prélevés à l'électrode et enfin en recherchant dans une table la masse molaire du Nickel tu pourras calculer la diminution de masse de cette électrode.
'une mole d'électrons porte une charge de 1Faraday soit de 96500C
Étant donné que 2 moles d'électrons ont circulé.. À quoi nous servira Q=200C dans la résolution de notre exercice
Non, on ne peut pas dire que 2 moles d'électrons ont circulé.
Si deux moles d'électrons avaient circulé, il aurait circulé (2*96500) = 193000C et non 200C comme indiqué par l'énoncé.
J'ai écrit "Chaque fois qu'il circule 2 moles d'électrons, il disparait en même temps 1 mole d'atomes de Nickel "
Cela ne veut pas dire qu'il a circulé vraiment 2 moles d'électrons, cela veut seulement dire qu'il circule 2 fois plus de moles d'électrons qu'il ne disparait en même temps de moles d'atomes de Nickel.
En termes mathématiques :
n(Ni disparu) = n(électrons ayant circulé)/2
Il te faut donc trouver le nombre de moles d'électrons correspondant à une charge de 200C, puis en déduire le nombre de moles d'atomes de Nickel disparus.
Bjr.
Svp.. Je ne comprends tjrs pas la logique. Surtout au niveau de la quantité d'électricité . Quelle est la différence entre le Q =96500c et le Q=200c.
Même pour la variation de masse
Bonjour,
96500C est la charge électrique transportée par une mole d'électrons. C'est une constante physique immuable.
200C est la charge électrique transportée dans ton exercice par le fonctionnement de cette pile ( et pas une autre) que tu étudies. Si, par exemple, cette pile fonctionnait plus longtemps ou si elle débitait un courant plus fort alors cette charge transportée serait plus grande.
On se trouve donc devant la situation suivante :
D'une part l'énoncé t'indique (de manière hélas très confuse) que la pile que tu étudies transporte en fonctionnant une charge de 200C.
D'autre part une mole d'électrons transporte 96500C
Or tu cherches à savoir combien de moles d'électrons sont transportées par 200C
C'est donc juste un question de proportionnalité :
1 mole d'électrons transporte 96500 C
x moles d'électrons transportent 200C
Que vaut x ?
Non.
Une charge de 200C est transportée par X =200/96500 = 2,07.10-3 moles d'électrons.
Et maintenant on retourne à la demi-équation qui se produit dans la demi-pile côté Nickel
(1) Ni  (1) Ni2+ + 2e-
(1) Ni2+ + 2e-
En général les nombres (1) sont sous entendus, mais je préfère exceptionnellement les faire figurer pour t'aider à comprendre.
Les coefficients 1 (pour le Nickel) et 2 (pour les électrons) montrent que chaque fois qu'un atome de Nickel réagit il libère 2 électrons qui vont être mis en circulation.
Tu sais maintenant que 2,07.10-3 moles d'électrons ont été mis en circulation, tu peux donc calculer le nombre de moles d'atomes de Nickel qui ont réagi et ensuite en utilisant la masse molaire atomique du Nickel tu obtiendras la masse de Nickel qui a réagi.
Ce Nickel est prélevé à l'électrode en Nickel qui va donc subir une diminution de masse.
OK. La masse du nickel que je vais trouver est celle ayant réagi.
NB: Ce Nickel est prélevé à l'électrode en Nickel qui va donc subir une diminution de masse.
Je n'ai pas la masse initiale du métal nickel .comment je fais donc pour calculer cette diminution de masse (sachant que variation de masse =masse finale -masse initiale) 🤤
Tu n'as pas besoin de connaitre la masse initiale de l'électrode de Nickel.
C'est la masse du Nickel qui a réagi qui est égale à la diminution de la masse de l'électrode.
De rien.
Sauf erreur de calcul de ma part, tu devrais trouver que la masse de l'électrode de Nickel a diminué de 0,061g
Le processus à suivre pour calculer l'augmentation de la masse de l'électrode en Argent est le même que pour le calcul de la diminution de la masse de l'électrode en Nickel.
Enfin, si tu restes intéressée par la question de l'électroneutralité des solutions, fais le moi savoir et j'essaierai de te donner des explications à ce sujet


