Inscription / Connexion Nouveau Sujet
Les liaisons covalentes, qui sont-elles ?
Bonjour.
Tout d'abord, comme c'est mon premier message sur ce site qui est je trouve, pas mal fait du tout, une petite présentation s'impose : je suis Quentin, j'ai 16 ans, je suis en 1 ère S.
J'ai une petite question au niveau des molécules.
Imaginons trois atomes, un atome d'oxygène et deux atomes d'hydrogène.
L'Oxygène fait deux liaisons, l'hydrogène une chaqu'un, donc, on se retrouve avec une molécule comme ça :
O
/ \
H H
J'ai quelques questions la-dessus :
1- Quelle est l'interaction qui est responsable de la liaison covalente ?
2- Est-ce le noyau de l'oxygène qui attire les deux atomes de l'hydrogène, ou est-ce les électrons de l'oxygène qui attire les deux atomes ou bien autre chose, bref pourquoi et comment se forme la liaison ?
3- D'où vient la règle de l'octet, c'est à dire pourquoi à partir du moment que la dernière couche est de 8 ou 2 électrons, il n'y a plus aucune interaction ?
Merci d'avance pour vos réponses.
la régle de l'octet c'est des atomes qui vont vouloir adapter la couche électronique externe des gaz nobles ou rares ou parfaits(je sais plus).[quote]
Merci pour ta réponse.
Cependant, quand je ce que je demandais c'est *pourquoi* quand la dernière couche d'un atome à 8 ou 2 électrons, aucunes liaisons n'est possible.
Pour l'interaction électrique, en es-tu sur ?
Salut !
!
Bienvenue à toi sur l'
1) Un atome est dans son état le plus stable quand sa couche de valence est la même que celle du gaz rare le plus proche (règle de l'octet) ; il va donc tenter d'acquérir cette structure électronique par perte, gain ou mise en commun d'électrons. Ces différents processus vont permettre aux atomes de se lier entre eux et conduire aux différentes liaisons chimiques.
Il s'agit d'un partage d'électrons afin de compléter la couche électronique externe des atomes impliqués.
C'est une liaison dirigée: il y a une forte probabilité que les électrons participant à la liaison se trouvent dans la direction formée par le centre de 2 atomes.
C'est une liaison de forte énergie d'où présence d'un cristal compact, de forte cohésion et d'une très grande dureté. Tous les électrons sont localisés et ne sont donc pas conducteur d'électricité.
La cohésion d'un cristal ionique est assurée par :
- l'interaction électromagnétique à l'échelle des atomes, des molécules et de la matière à l'échelle humaine;
- l'interaction forte à l'échelle du noyau.
Il existe d'autres interactions comme celle de la gravité. Mais elles sont négligeables à cette échelle de la matière. En effet, la gravité est proportionnelle à la masse et à l'échelle atomique les masses sont infimes.
La liaison covalente tend à être plus forte que d'autres types de liaison, telle que la liaison ionique. De plus, au contraire des liaisons ioniques où les atomes sont liés par attraction coulombienne non-directionnelle, les liaisons covalentes sont fortement directionnelles. En conséquence, les molécules liées par covalence tendent à adopter des formes caractéristiques possédant des angles de liaison spécifiques.
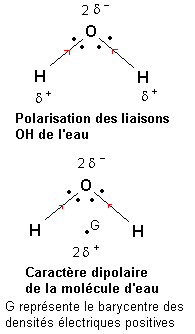
2) L'électronégativité de l'oxygène est plus forte que celle de l'hydrogène. Une étude du déplacement des doublets de liaison montre que les liaisons O—H de la molécule d'eau sont polarisées de telle façon que l'oxygène porte une densité électrique négative (2 -) et que chaque hydrogène porte une densité électrique positive (
-) et que chaque hydrogène porte une densité électrique positive ( +).
+).
Le barycentre des densités électriques positives se situe au milieu du segment joignant les deux atomes d'hydrogène. Il apparaît alors qu'étant donnée la forme de la molécule d'eau, les barycentres des densités électriques positives et négatives sont distincts. La molécule d'eau présente un caractère polaire (on dit dipolaire si il y a deux pôles).
Ce caractère dipolaire de la molécule d'eau lui confère des propriétés de solvant très particulier (ce n'est pas le seul solvant dans ce cas).
3) Lorsque les atomes subissent des transformations (transformation en ion monoatomique ou lorsque qu'ils établissent des liaisons avec d'autres atomes) ils le font de façon à saturer leur couche externe. Cette saturation va leur conférer une stabilité. Les atomes dont la couche externe est déjà saturée ne donneront donc pas d'ion monoatomique et n'auront pas tendance à établir de liaison avec d'autres atomes. Ils sont dits "chimiquement stables". On dit aussi qu'ils présentent une grande inertie chimique.
Au cours de leurs transformations chimiques, les atomes caractérisés par Z  4 évoluent de manière à saturer leur couche (K).Ils acquièrent un "duet" d'électrons c'est-à-dire une paire d'électrons.
4 évoluent de manière à saturer leur couche (K).Ils acquièrent un "duet" d'électrons c'est-à-dire une paire d'électrons.
Au cours de leurs transformations chimiques, les atomes caractérisés par Z > 4 évoluent de manière à saturer leur couche externe (L) ou (M) etc.... Ils acquièrent un "octet" d'électrons c'est-à-dire 8 électrons ou 4 paires d'électrons.
Il existe des exceptions à la règle de l'octet mais on ne les voit pas au lycée (tp complexe et surtout pas assez d'outils pr comprendre ).
).
Merci pour cette réponse complète  !
!
Je pense actuellement que l'interraction responsable de la liaison convalante est la même que celle qui maintient les électrons autours du noyeau de l'atome (interraction faible ?).
Mais je pense surtout aussi que cela n'est pas du programme de 1ère S.
Pendant ces 6-7 derniers jours, j'ai fait pas mal de révision, et je remarque que l'on nous cache la moitié des choses, comme si c'était évident.
Par exemple, lorsque l'on dissout de l'HCl dans de l'eau, on a :
H (K(1) donc, doit gagner un électron) et (Cl K(2) L(8) M(7) doit gagner un électron).
Donc, logiquement, ça fait une molécule : H--Cl.
Ensuite on rajoute de l'eau, on mélange, et paf, ça fait des chocapics :-° : on se retrouve avec des H+ et des Cl-.
Donc, moi je dirais que que comme H--Cl est polarisée, et se lie avec d'autres H--Cl, et ça épuise les liaisons covalentes, y'a donc des H, des Cl et de l'eau qui se balade, et ça forme des H+ et des Cl- : mystère...
Dans tous les cas, il doit y avoir un rapport entre l'électronégativité (d'ailleurs c'est quoi ça exactement, on en parle comme si ça coulait de source dans mon livre ><) et les chagres.
Je pense que ça demande une exlpication  !
!
A+
Bon, en fait, après intense réflexion, je pense avoir compris.
H--Cl est polarisée, donc, elle a deux poles, et les molécules HCl s'assemblent :
H--Cl-----H--Cl-----H--Cl
Bref, pendant ce temps la, comme Cl est plus électronégatif que H, les électrons de la liaison covalentes remontent vers vers Cl.
Puis, la liaison inter-moléculaire épuise et fait casser les liaisons covalentes.
H et Cl se dissocient, et comme Cl garde l'électron en plus, il devient Cl- et l'autre H+ :-°.
C'est bien ça docteur  ?
?


