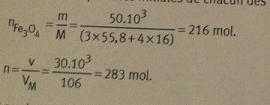Inscription / Connexion Nouveau Sujet
Le haut-fourneau
Salut tout le monde j'aimerai bien qu'on m'aide pour le numeros 4,5,6 car je bloque sur ces numeros.
Un haut fourneau est un four à combustion interne, destiné à la fabrication de
la fonte à partir du minerai de fer. Une réaction se produisant dans un haut fourneau
met en jeu les réactifs : la magnétite Fe3O4 et le monoxyde de carbone CO
ainsi que les produits : le fer et le dioxyde de carbone.
1 Pourquoi peut-on dire qu'une transformation chimique s'est produite ?
2 Écrire l'équation chimique symbolisant cette réaction.
3 Décrire le test d'identification du dioxyde de carbone.
On considère la réaction de 50,0 kg de magnétite solide avec 300 m3 de monoxyde de carbone
gazeux à 1000°C et à la pression atmosphérique.
4 Dresser un tableau descriptif de l'évolution de l'état du système lors de sa transformation.
5 Calculer l'avancement maximal Xmax.
6 En déduire la composition (en mol) du système à l'état final.
Données : Masses molaires atomiques (en g.mol-1) : Fe : 55,8 ; O : 16,0 ; C : 12,0.
Volume molaire VM d'un gaz à 1000°C et à la pression atmosphérique :
106,0 L.mol-1.
Voila ce que j'ai fais :
1) On peux dire qu'une transformation chimique s'est produite car on obtient un produit.
2) ) La magnétite + le monoxyde de carbone → le fer + le dioxyde de carbone : Fe3O4 + CO → Fe + CO2
3) Il faire tremper du dioxyde de carbone dans un tube à essai contenant 2-3 mL d'une solution d'hydroxyde de calcium (eau de chaux).
Il se forme de l'eau et du carbonate de calcium insoluble.
4)
5)
6)
Merci d'avance.
Bonjour,
Pour la 4, il faut faire un tableau d'avancement.
Cela implique d'abord de calculer le nombre de moles des réactifs à l'état initial.
3) voila ce que j'ai comme tableau, mais je sais pas si c'est bon, apres je bloque sur le numero 4,5,6.
Masse molaire de Fe3O4 :
(3 chiffres significatifs)
Nombre de moles de Fe3O4 :
(3 chiffres significatifs)
Nombre de moles pour le CO :
(3 chiffres significatifs)
Es-tu d'accord avec ça ?
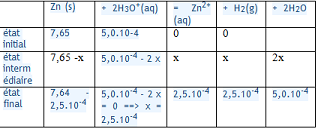
question 4
| Fe3O4 | + 4 CO |  3 Fe 3 Fe | + 4 CO2 | |
| état initial | 2,16.102 | 2,83.103 | 0 | 0 |
| état intermédiaire | 2,16.102 - x | 2,83.103 - 4 x | 3 x | 4 x |
| état final | 2,16.102 - xmax | 2,83.103 - 4 xmax | 3 xmax | 4 xmax |
Es-tu d'accord avec ça ?
Question 5
La réaction s'arrête lorsque un réactif est épuisé.
Pour Fe3O4, on a xmax = 2,16.102 mol .
Pour CO, on a xmax = 2,83.103 / 4 = 7,08.102 mol.
Donc xmax = 2,16.102 mol .
4 et 5 je suis d'accord, mais (3 chiffres significatifs) le 4 sa devient 216, 283, alors dans le tableau je le met en ainsi ? et pour le 5 sa devient 70,8mol.
Voilà j'ai re fait le devoir, et vérifie si mes réponses sont correctes ou pas, mais pour le numéro 6 je bloque car ce n'est pas la bonne réponse que tu as donné.
1) On peux dire qu'une transformation chimique s'est produite car on obtient un produit.
2) ) La magnétite + le monoxyde de carbone → le fer + le dioxyde de carbone : Fe3O4 + CO → Fe + CO2
3) Il faire tremper du dioxyde de carbone dans un tube à essai contenant 2-3 mL d'une solution d'hydroxyde de calcium (eau de chaux).
Il se forme de l'eau et du carbonate de calcium insoluble.
4) Masse molaire de Fe3O4: m = 3 * 55,8 + 4 * 16,0 = 231 g/mol.
D'après la définition de la masse molaire ,on a la relation :
n= m/M n : quantité de matière (mol).
m : masse (g)
M : masse molaire (g.mol -1)
Nombre de moles pour le Fe3O4:
On as donc nFeO4 = 50,0 x 1000/ 231 = 216 mol de Fe3O4.
De la définition du volume molaire, on obtient la relation :
n= v/ Vm n: quantité de matière.
v: volume (L).
Vm: volume molaire (L.mol-1).
Nombre de moles pour le CO:
On as donc nCO = 300*1000/106. = 283 mol de CO.
5) La réaction s'arrête lorsque un réactif est épuisé.
Pour Fe3O4, on a xmax = 216 mol .
Pour CO, on a xmax = 283/ 4 = 70,8 mol.
La valeur minimale de Xmax nous donne le réactif limitant : CO .La bonne valeur de Xmax est donc : 70,8 mol.
6) Je bloque.
et aider moi s'il vous plait pour la question 6 ,car la reponse devrait etre : ce que j'ai poster au - bas ,mais j'arrive pas a le calculer .
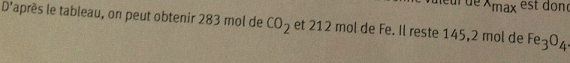
1) OK si on veut... On peut dire que l'on a une réaction chimique parce que les réactifs (magnétite et monoxyde de carbone) se sont transformés pour donner des produits (fer et dioxyde de carbone).
2) La réaction n'est pas équilibrée
3) OK
4)OK pour le nombre de moles de Fe3O4
Mais le nombre de moles de CO est faux. Si tu ne veux pas écrire (pourquoi ? ), écris 2830 mol (ou 283.101, c'est plus exact)
(pas 283 mol, ce n'est pas la même chose ! ). 300 1000 / 106,0
1000 / 106,0  283 .
283 .
Mais, pour 3 chiffres significatifs, c'est mon écriture qui est correcte. Avec 2830, on va croire qu'il y a 4 chiffres significatifs.
5)
OK pour Fe3O4 mais pas pour CO (c'est 2830 / 4 et non pas 283 / 4)
6)
Jusqu'à preuve du contraire, mes résultats sont exacts.
2) Fe3O4 + 4CO → 3Fe + 4CO2
4) Pour CO tu peut mettre le calcul pour que je comprend plus clairement.
5) Co ,la meme chose pour que je puisse le comprendre.
6)mais le petit dessin que j'ai mit indique qu'on doit avoir cette reponses la 
mais faut- t'il cacuculer pour le 6 ? pour le 4 CO et 5 C0 esque tu pourras mettre les 2 caclcule pour que je comprend mieux ?
On a 300 m3 de CO à 1000°C. Le volume molaire d'un gaz à cette température et à la pression atmosphérique est 106,0 mol.L-1.
300 m3, ça fait bien 300 1000 L !!...
1000 L !!...
Donc le nombre de moles est bien :
Et ma calculatrice donne comme réponse à ce calcul : 2830,188679 ( pas 283,0188679 ! )
Avec 3 chiffres significatifs, ça donne bien
Es-tu d'accord avec ce calcul ?
oui totalement d;accod avec toi, mais quand sa devient 3 significatif sa devient 283 ,parceque sa donne sa quand tu regarde bien :

Pour autant que je puisse déchiffrer quelque chose (c'est à peu près illisible ! ), il s'agit de 30 m3 et non pas 300 m3 pour CO !
Tu as fait une erreur dans l'énoncé !...
On considère la réaction de 50,0 kg de magnétite solide avec 300 m3 de monoxyde de carbone
gazeux à 1000°C et à la pression atmosphérique.
voila l'énoncé .( motier de l'énoncé .0
Alors, c'est une erreur de l'énoncé ou de la correction...
Dans l'énoncé, c'est 300 m3
Dans la correction, c'est 30 m3 (pour autant que je puisse lire ! ).
Tu peux faire un agrandissement sur "Calculons les quantités de matière initiales de chacun des réactifs :"
et les 2 lignes qui suivent.
C'est bien ce que j'ai dit !... Il y a une incohérence.
Dans l'énoncé, c'est 300 m3
Dans la correction, c'est 30 m3
Je peux refaire l'exo avec 30 m3...
Es que tu peut m'aide a refaire l'exo de ou on etait bloquer js qu'a 6 ? car sa fait 2 jours que je suis sur cette excercice qui me bloque .
Question 4
Masse molaire de Fe3O4 :
(3 chiffres significatifs)
Nombre de moles de Fe3O4 :
(3 chiffres significatifs)
Nombre de moles pour le CO :
(3 chiffres significatifs)
question 4
Fe3O4 + 4 CO 3 Fe + 4 CO2
état initial 2,16.102 2,83.103 0 0
état intermédiaire 2,16.102 - x 2,83.103 - 4 x 3 x 4 x
état final 2,16.102 - xmax 2,83.103 - 4 xmax 3 xmax 4 xmax
| Fe3O4 | + 4 CO |  3 Fe 3 Fe | + 4 CO2 | |
| état initial | 216 | 283 | 0 | 0 |
| état intermédiaire | 216 - x | 283 - 4 x | 3 x | 4 x |
| état final | 216 - xmax | 283 - 4 xmax | 3 xmax | 4 xmax |
Question 5
Pour Fe, 216 - xmax = 0  xmax = 216
xmax = 216
Pour CO, 283 - 4 xmax = 0  xmax = 283 / 4 = 70,8 mol
xmax = 283 / 4 = 70,8 mol
Donc il faut prendre le plus petit  xmax = 70,8 mol
xmax = 70,8 mol
Question 6
D'après le tableau :
Pour Fe, on a 3 xmax
Donc
Pour CO, on a 4 xmax
Donc
Il reste 145 moles de magnétite et tout le CO a été consommé (réactif limitant).


 .
.