Inscription / Connexion Nouveau Sujet
Le benzène
Bonjour,
Merci par avance.
Ton voisin de classe accompagne son père à l'hôpital pour une intervention chirurgicale . Entre autres produits , le médecin leur prescrit la procaïne , composé organique utilisé dans la préparation de l'anesthésie locale . L'élève s'informe ensuite et découvre qu'un autre composé A de formule brute entre dans la synthèse de la procaïne . Ce composé A est obtenu de façon majoritaire par nitration du Toluène .B est un minoritaire .
Après la guérison de son père , ton voisin te donne toutes ces informations et te sollicite pour l'aider à déterminer les quantités des composés A et B produits à partir de 5g de Toluène .
Données : Mc=12 g/mol , MH=1g/mol , MN=14g/mol , Mo=16g/mol, Vm=24L/mol.
1) Donner la formule brute du Toluène.
2)
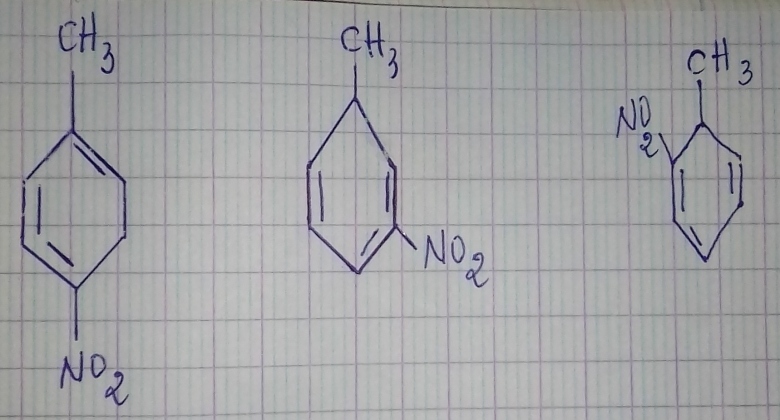
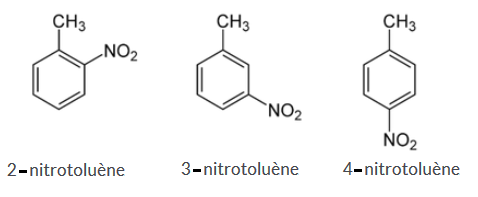
2-1) Écrire les formules semi développées possibles du composé A .
2-2)Les nommer .
3- Écrire l'équation bilan de la réaction de nitration du Toluène.
4-)
4-1) La masse du composé A obtenu.
4-2) La masse du corps B formé .
***Titre changé***
Voilà copier coller ,
***Réponse 2 du professeur (suite à la précision apportée par odbugt1 à 19h43) :***
Fais comme tu penses....
Bonsoir à vous deux,
@odbugt1 : je pense que les propos mis en italique correspondent aux deux réponses reçues par kamikaz de la part de son professeur 
Bon ....
Et bien je suggère à kamikaz de proposer une réponse à la question 2
Et de faire ..... comme il veut.
Pour ma part, j'ai une réponse à apporter si la formule est C7H7NO2 mais je n'en ai pas si c'est C7H8NO2
Très étrange que ton prof te laisse continuer l'exercice avec une erreur aussi flagrante et qu'il ne s'en rende même pas compte.
Pas tout à fait.
Tu peux constater que l'élément H n'est pas équilibré dans ta réaction.
La nitration du toluène se fait à partir de l'acide nitrique HNO3
L'équation de la réaction est :
C7H8 + HNO3  C7H7NO2 + H2O
C7H7NO2 + H2O