Inscription / Connexion Nouveau Sujet
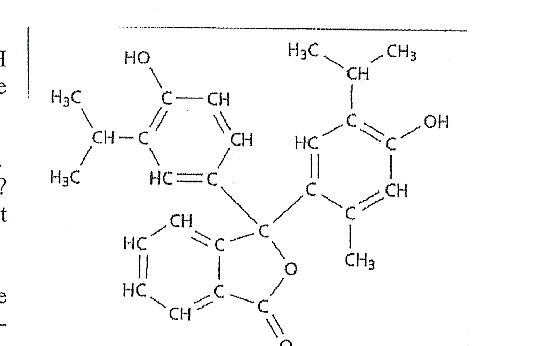
La thylmophtaléine (DM)
Bonjour, bonsoir, j'ai besoin d'un peu d'aide.
1) Est ce une molécule organique ? Justifier.
Une molécule organique contient principalement les éléments carbone et hydrogène, on peut donc considérer cette molécule comme organique.
2) Y a t il des liaisons doubles conjuguées ? Combien ?
Oui. Neuf.
3) Pourquoi cette molécule n'est elle pas colorée ?
C'est ici que je commence à coincer...
J'ai répondu qu'elle ne contenait pas suffisamment de LDC ni de groupes caractéristiques, mais je doute.
Je n'ai aucune idée des réponses aux questions suivantes...
4) Par quelle expérience vérifier qu'il s'agit bien d'un indicateur acido basique ?
5) Une solution de cette molécule est incolore en dessous de pH = 9,0. Pour un pH supérieur à 10.5 cet indicaateur est bleu. S'agit il de la forme basique ou acide de cet indicateur ?
Basique ?
6) Quelle est la couleur de la solution pour : pH entre 9.0 et 10.5 ? Justifier.
7) Quel atome de la molécule représentée doit avoir sa structure modifiée pour que l'autre forme soit colorée ?
8) Est il possible de déduire la couleur de la forme basique ? Quelles sont les plages de radiation absorbées ? Qu'en est il de la forme acide ?
J'ai vraiment besoin de votre aide, merci d'avance...
Par quelle expérience vérifier qu'il s'agit bien d'un indicateur acido basique ?
Un indicateur acido-basique change de couleur lorsqu'il est en présence d'acide ou de base.
Il suffit juste de le mettre en milieu basique, et en milieu acide, et d'observer les changements de couleurs.
Une solution de cette molécule est incolore en dessous de pH = 9,0. Pour un pH supérieur à 10.5 cet indicaateur est bleu. S'agit il de la forme basique ou acide de cet indicateur ?
Basique ?
Si il est incolore en dessous de 9.0, difficile d'observer si le milieu est acide.
Cependant, puisqu'il devient bleu pour un pH supérieur à 10.5, alors on va pouvoir détecter, en le versant dans une solution, si la solution est basique ou non. Si la solution vire au bleu alors, elle sera basique.
Il s'agit donc de la forme basique de cet indicateur.
6) Quelle est la couleur de la solution pour : pH entre 9.0 et 10.5 ? Justifier.
L'indicateur est dans sa zone de virage, on verra donc la solution viré lentement au bleu.
Malheureusement, je ne fais pas d'études de chimie et la chimie de lycée commence à être loin derrière moi.
Je ne peux t'aider plus que ça.


