Inscription / Connexion Nouveau Sujet
La pile cuivre plomb
Bonjour,
Jai l'exercice suivant à faire :
Dans un bêcher on met en présence une solution bleue de sulfate de cuivre avec une solution incolore de sulfate de plomb. On plonge une lame de plomb et un fil de cuivre dans le milieu obtenu.
Après quelques minutes, on observe la décoloration de la solution et un dépôt rouge sur la la lame de plomb.
1) écrire les demi équations doxydoreduction associées aux couples oxydant réducteur en présence.
J'ai trouver cu2+ + 2e- = cu (s) oxydant
Pb = pb 2+ + 2e- réducteur
Après je n'y arrive pas :
2) déduire des résultats expérimentaux l'équation de la réaction doxydoreduction dont le système chimique est le siège.
3) schématiser la pile que l'on peut réaliser à l'aide de ces couples oxydant/réducteur
4) faire figurer sur le schéma un ampèremètre de telle façon que le courant qui le traverse soit lue positivement
5) faire apparaître sur le schéma le mouvement de tous les porteurs de charges. je pense que les ions - vont vers la borne - et les ions + vers la borne + ?
Merci d'avance
SLT
voila mon avis sur la question :
2 - reaction d'oxydo reduction
Cu2++ Pb ======) Pb2++ Cu
3 et 4 -
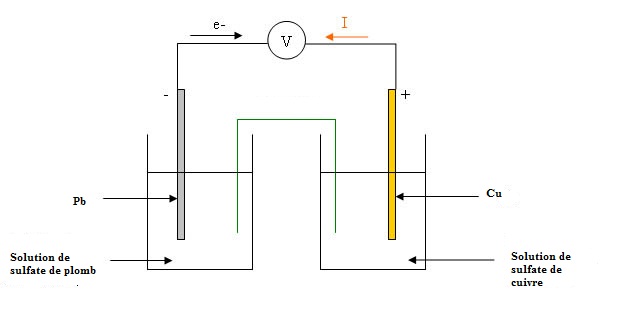

 Cu(s)
Cu(s)

