Inscription / Connexion Nouveau Sujet
La mole et quantité de matière
Bonjour, exercice sur la quantité de matière :
Quelle est la quantité de matière de méthanol (CH3OH)contenue dans un volume de éthanol pur V=30mL, sachant que la masse volumique  = 0.79 g/mL et que sa masse molaire moléculaire est M=32.0 g/mol.
= 0.79 g/mL et que sa masse molaire moléculaire est M=32.0 g/mol.
Aide : La masse volumique  est le rapport de la masse m du liquide sur le volume du liquide V ; Formule :
est le rapport de la masse m du liquide sur le volume du liquide V ; Formule :  = m/v
= m/v
Salut,
Le principe du forum n'est pas de poster des exercices bruts, et d'attendre que quelqu'un vienne le résoudre.
Nous sommes là pour t'aider, à condition que tu te donnes la peine de le chercher un peu.
Dans un exercice de chimie, je te conseille de schématiser toujours l'énoncé pour avoir les idées claires sur les données d'entrée :
Quelle est la quantité de matière de méthanol (CH3OH)contenue dans un volume de éthanol pur V=30mL, sachant que la masse volumique = 0.79 g/mL et que sa masse molaire moléculaire est M=32.0 g/mol.
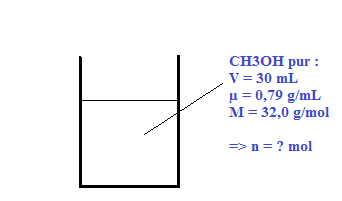
Quelle est la définition de la quantité de matière ? Quelle formule peut-on utiliser ?
La formule pour la quantité de matière c'est :
n = N/Na
n : la quantité de matière (mol)
N : le nombre d'entités
NA : constante d'Avogadro qui vaut 6,02 x 1023 mol
Oui, c'est la définition générale, maintenant, est-ce qu'à partir de l'énoncé schématisé, tu aurais une idée sur une autre expression de la quantité de matière pour cet exercice ?
Tu vois quand tu veux  .
.
Par définition, la quantité de matière d'un corps de masse m et de masse molaire M est (1)
La masse molaire du méthanol nous est donnée dans l'énoncé de l'exercice.
Il reste donc à exprimer la masse de l'éthanol.
Or d'après l'énoncé, on sait par définition que la masse volumique du méthanol de masse m et de volume V est :
(2)
Finalement, en utilisant les équations (1) et (2), nous obtenons :





