Inscription / Connexion Nouveau Sujet
La chimie du cuivre
Bojour, je suis un élève de 1ère. J'ai deux exercices à faire et je ne suis pas totalement sûr de mes reponses. J'espère que vous pouvez me conseiller.
Le cuivre est l'un des premier métaux élaborés à partir de son minerai, vraisemblablement dès le VIe siècle millénaire avant JC. Le minerai, contenant de l'oxyde de cuivre CuO était chauffé, dans un four en terre, en présence de charbon de bois, essentiellement du carbone C. L'équation chimique de la transformation qui lieue est :
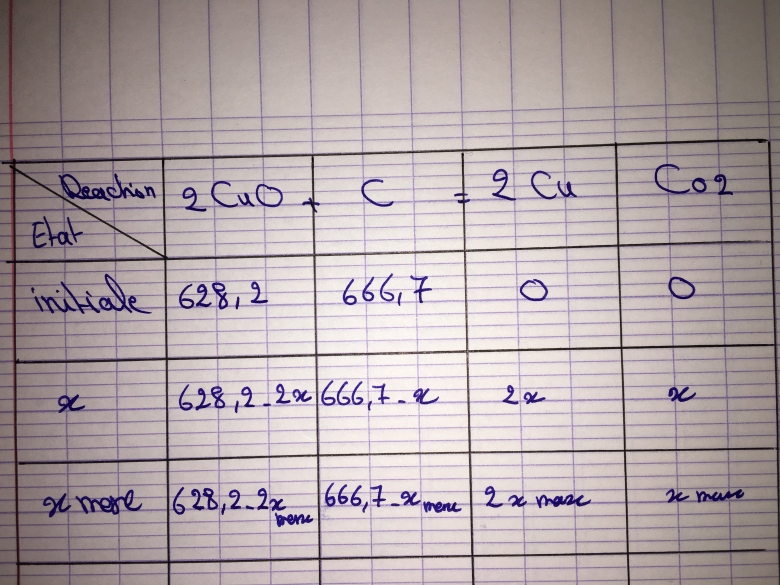
2 CuO + C = 2 Cu + CO2
On considère que la transformation a lieu entre 50kg de minerai pur et 8kg de charbon (carbone pur)
Données : Masse molaire atomique: M(Cu) = 63,6g.mol-1 , M(C)= 12g.mol-1 et M(O) = 16g.mol-1
1) Déterminer la masse molaire moléculaire de l'oxyde de cuivre:
M(CuO) = M(Cu) + M(O)
= 63.6 + 16
= 79.6 g.mol-1
2) Déterminer les quantités de matière initiale en oxyde de cuivre et en carbone lors de la transformation:
n(CuO)= 50000g/ 79.6g.mol-1= 628.2mol
n(C) = 8000g/12g.mol-1 = 666.7mol
3) dresser le tableau d'avancement, déterminer l'avancement maximal et le bilan de matière à l'état final:
Pour 2CuO : 628.2-2x max, on aura x max = 314.1 mol
Et pour C : 666.7-xmax, on aura x max =666.7 mol
Donc le limitant est l'oxyde de cuivre et l'état final est gazeux parce qu'il restera que le carbone.
4) calculer la masse de cuivre formé lors de cette tansformation:
m(CuO) = 314.1 * 79,6 = 25002.36g
Donc presque 25kg.
Qu'est ce que vous en pensez ?
Merci.
Bonsoir,
Ton calcul est bien mené.
Je n'ai pas vérifié les valeurs numériques des résultats.
Toutefois j'ai constaté que pour calculer la masse du cuivre formé tu te sers de la masse molaire de l'oxyde de cuivre. Simple distraction probablement.
A l'état final tu as :
Du carbone en excès ( puisque c'est CuO qui est le réactif limitant )
Du cuivre
Du monoxyde de carbone dont la formule n'est pas Co comme tu l'as écrit sur ton document joint mais CO
Co est le cobalt. Rien à voir avec CO
Si xmax = 314,1 mol (Je n'ai pas vérifié)
Le tableau d'avancement indique que n(Cu) = 2 * xmax
m(Cu) = n(Cu)*M(Cu) = 2 * 314,1 * 63,6 =3,99.104 g soit environ 40kg
Oui c'est bien ce que j'ai trouvé apres que j'ai corrigé ma faute. Merci
J'ai un exercice où j'ai plus des difficultés. Est ce que ca sera possible que vouz m'aidez ?
Ouvre un autre topic et poste le.
Si ce n'est pas moi, et pour peu que tu postes un énoncé complet, il se trouvera quelqu'un pour t'aider.


