Inscription / Connexion Nouveau Sujet
Glycémie
Bonjour jai un probleme ou je n'arrive pas a repondre a toutes les qst
Merci d'avance
La glycemie est inferieure a 0,70 g.L^-1,on dit que la personne est en hypoglycémie. Si elle est supérieure a 1,10g.L^-1 la personne est en hypoglycemie.si son taux de glucose depasse 1,26 g.L^-1, la personne souffre de diabete
3)la molecule de glucose comporte 5 groupes hydroxyle chacun etant caracteristique dune fonction alcool.Preciser la classe de ces fonctions alcool en justifiant la reponse
5 ) justifier l'équivalence entre les grandeurs 0,82g.L^-1 et 4,55 mmol.L^-1
6)que peut on dire de la glycemie de cette adolescent
7) quelle masse minimale de glucose possede un diabetique dans 0,5 L de son sang?
La glycemie est inferieure a 0,70 g.L^-1,on dit que la personne est en hypoglycémie. Si elle est supérieure a 1,10g.L^-1 la personne est en hypoglycemie.
Là il y a comme un problème !
Question 3 : Il faut écrire la formule développée du glucose, repérer les fonctions alcools et attribuer à chacune d'elles leur classe.
Question 5 : On passe de la masse du glucose à la quantité de matière par l'intermédiaire de la masse moléculaire et on trouve en effet que 0,82g équivaut à 4,55 mmol
Question 6 : Un adolescent ? Quel adolescent ?
Question 6 : Utiliser la donnée de l'énoncé qui précise le seuil de concentration massique de glucose dans le sang pour un diabétique.
Ce n'est pas très constructif de se déclarer "bloqué" sans tenter quoi que ce soit, ne serait ce que de revenir au cours.
Par exemple:
Question 3 :
Formule développée du glucose ( se trouve dans le cours ou sur internet ).
Fonction alcool ( se trouve dans le cours ou sur internet ).
Classe des fonctions alcools dans le glucose. (Alcool primaire, secondaire, tertiaire)
Evidemment cela ne viendra pas tout seul. Recherches indispensables.
En cas de difficultés, revenir poster des questions précises
OK
A partir de cette formule tu retrouves les 5 groupes hydroxyles dont parle l'énoncé et à partir des définitions ( à connaître ) des alcools primaires, secondaires, tertiaires tu dois pouvoir être en mesure de répondre à la question 3
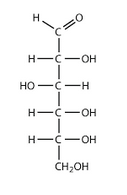
Cho= alcool primaire. Non, cette fonction n'est pas une fonction alcool
Ch2oh=alcool primaire Oui, à condition de l'écrire correctement CH2OH, les minuscules et les majuscules ne s'improvisent pas.
Question 5 :
Comme je te l'ai déjà indiqué cette question nécessite d'abord que tu calcules la masse molaire du glucose.
Nous sommes d'accord.
Ce résultat indique que 180 g de glucose équivalent à 1 mole de ce composé.
Alors, si au lieu de 180g on a seulement 0,82g de glucose , il n'est pas très difficile de trouver l'équivalent en moles.
Non.
On applique les bonnes vieilles règles de la proportionnalité, connues aussi sous le nom de produit en crois ou encore de règle de trois.
Si 180g de glucose égalent 1 mole de glucose, combien de moles égalent 0,82 g ?
Non
Dire que les masses sont proportionnelles aux quantités de matière revient à dire que le rapport des masses
( ici 180g / 0,82g ) est égal au rapport des quantités de matière ( ici 1mol / ? )
Il s'agit donc de trouver ( en mol ) la valeur de " ? "
Toujours pas.
En d'autres termes ( je remplace le point d'interrogation par " x " qui est l'inconnue) tu dois résoudre l'équation :



