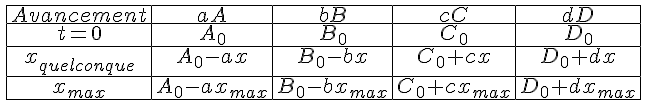Inscription / Connexion Nouveau Sujet
Feu de bengale
bonjour ,
Je suis bloquée actuellement sur ce devoir donné !
Exercice : Un artificier prépare un feu de bengale rouge. Il mélange 61,6g de chlorate de potassium KCIO3(s), 8,0g de soufre S et 9,0g de carbone. Lors de la mise à feu, il se produit la réaction d'équation :
2 KCIO3(s) + S(s) + 3 C(s) -> K2S(s) + 3 CO2(g) + CI2(g)
Données : Masses molaires M(KCIO3) = 122,6g/mol-1
M(S) = 32,1g/mol-1
M(C) = 12,0g/mol-1
M(K2S) = 110,3g/mol-1
M(CI2) = 71,0g/mol-1
Questions :
1) calculer les quantités de matières des réactifs à l'état initial.
2) Exprimer les quantités de matières de chlorate de potassium et de carbone en fonction de la quantité de matière de soufre.
3)les réactifs sont-ils introduits dans les proportions stchiométriques? justifier.
4) Quel est le réactif limitant? Peut-on le retrouver en fin de réaction? Justifier
5)Donner le tableau d'avancement general pour cette réaction.
6) compléter le tableau d'avancement en donnant la quantité de matière des espèces présentent à l'état final.
Pour la première question voici ce que j'ai trouvé :
N(KCIO3)= m(KCIO3)/M(KCIO3) = 61,6/122,6 n=0,50 mol.
N(S)= m(S)/M(S) = 8,0/32,1 n=0,25mol
N(C) = m(C)/M(C) = 9,0/12,1 n= 0,75mol
Je suis bloqué pour les autres question ! Je serais en attente d'une reponse favorable le plus vite possible !
Salut  !
!
1) attention c'est "n", pas "N".
Sinon c'est ok
2) Fais un tableau d'avancement, c'est le plus simple pour visualiser cela. Tu as déjà vu ça ?
Oui désolé , erreur de frappe !
Non malheureusement je ne l'ai pas vu, j'étais absente lors de la leçon ! C'est pour cela que j'ai aucune idée de comment poursuivre mon dm
j'ai réalisé le tableau sur une feuille et je pense avoir trouvé les réponses , pouvez vous me dire si elles sont correctes ou pas ?
3) Non les réactifs ne sont pas introduits dans les proportion stchiométriques car ils ne sont pas proportionnels à leurs coefficients stoéchiometriques.
4) Le réactif limitant est le chlorure de potassium car il a disparu totalement au cours de la réaction chimique
Pour ces deux questions je ne sais pas si c'est correctement justifier
et pour la question 6) je bloque car normalement pour calculer une quantité de matière la formule à utiliser est : n=m/M mais je n'est pas le petit m pour les espèces présentes à l'état final , je n'ai que les grands M , comment dois-je procéder ?( la question est : compléter le tableau d'avancement en donnant la quantité de matière des espèces présentes à l'état final)
oui regarde sous le cadre de saisi de texte tu as une case (la 2ème en partant de la droite) qui te permet de créer des tableaux.
3) si, ils le sont.
| Etat du système | 2KCIO3(s) + | S (s) + | 3 C (s) | K2s(s) | 3Co2 (s) | Cl2 (s) | |
| Etat initial | x = 0 | 0,5 | 0,25 | 0,75 | 0 | 0 | 0 |
| Etat intermediaire | x | 0,5-x | 0,25-x | 0,75-x | x | 3x | x |
| Etat final | xmax | 0,5-2xmax | 0,25-xmax | 0,75-3xmax | xmax | 3xmax | xmax |
Ok ?
Oui il est ok ton tableau.
2) Tu décrètes que le soufre est le réactif limitant donc tu remplaces xmax par n(S)
Pourquoi le soufre est ici notre réactif limitant? Lorsque je remplace xmax par nS j'obtiens 0 cela veut dire quoi?
D'accord ! Donc pour exprimer les quantités de matieres de chlorure de potassium et de carbone en fonction du soufre il suffit juste de remplacer x Max par 0,25 ! Merci beaucoup pour votre aide!