Inscription / Connexion Nouveau Sujet
Fabrication d'un circuit imprimé
Bonjour à tous,
J'ai un DM à faire pour mardi et je sais pas comment faire..
Voilà le topo :
Une plaque en plastique est recouverte d'une couche de cuivre de 0.020mm d'épaisseur. On protège les parties que l'on veut garder intactes pour connecter les différents composants qui seront implantés sur le circuit, et on attaque le reste du cuivre par une solution oxydante de chlorure de fer (III)
a) En supposant que la surface de cuivre à éliminer occupe 50cm², calculer la masse de cuivre correspondante (on recherchera la valeur de la masse volumique du cuivre)
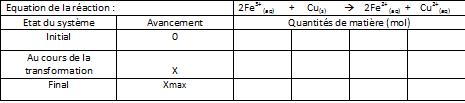
b) Le volume de la solution oxydante utilisé est Vo = 100mL. Quelle est la concentration minimale en ions Fe3+(aq) nécessaire pour éliminer l'excès de cuivre du circuit imprimé ? On complétera littéralement le tableau d'avancement suivant.
Merci d'avance !
Bonjour,
Oui, elle est de 8,96 g·L-1
Mais ensuite ?
Je connais n=m/M et n=P*V/M
Dois-je en déduire que P*V = m ? (m étant la masse)
Tu calcules la masse du cuivre à enlever. Tu as l'aire S = 50 cm2, l'épaisseur h = 0,020 mm
et la masse volumique ==> m =
==> m =  Sh avec les bonnes unités.
Sh avec les bonnes unités.
Après tu calcules le nombre de moles de cuivre n = m / M
Oui mais je réservais la surprise pour après ... Mais puisque le problème a été soulevé...
... Mais puisque le problème a été soulevé...
La masse volumique du cuivre est plutôt 8,96 g.cm-3 à 20°C soit 8,96 kg.L-1 ou encore 8,96.103 kg.m-3


 j'ai finis ce DM ^^
j'ai finis ce DM ^^
