Inscription / Connexion Nouveau Sujet
Exo-Physique-Chimie.
Bonjour j'ai un exercice, pourriez vous m'aider s'il vous plait ?
Voyager coûte cher en termes de pollution, et de bilan carbone.
Les chercheurs imaginent donc de nouvelles méthodes de production d'énergie, la plus écologique possible.
La pile à hydrogène fera peu être partie des solutions de demain.
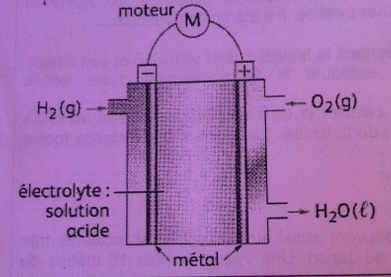
La pile à combustible est alimenté en dihydrogène et en dioxygène en continu.
Le réacteur est composé de deux compartiments reliés par un électrolyte acide.
Les couples oxydant/réducteur mis en jeu lors de la réaction sont : H+(aq)/H2(g) ; O2(g),H20(l)
1. Pour chaque couple, écrire la demi équation rédox.
H+ + 3e- --> H2
O2 + e- --> H2O
2. D'après la polarité de la pile, quelle est l'équation de la réaction qui a lieu quand la pile est en fonctionnement ?
H+ + 3e- --> H2
+
H2O --> O2 + e-
=
je voudrais savoir si les deux équations redox sont justes pour effectuer l'équation
3. Le dioxygène est le << combustible >> de la pile. Est ce un oxydant ou réducteur ?
c'est un réducteur ?
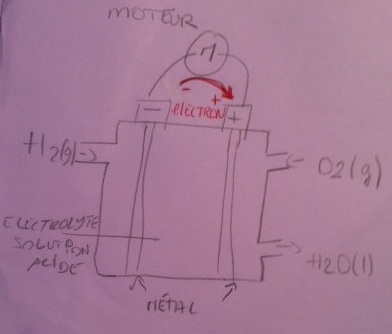
4. Recopier le schéma de la pile et indiquer le sens de circulation des électrons.
voir schéma donné et schéma main levée.
5. Citer l'un des intérêts de cette pile à combustible. Quelle est sa limite ?
Si les piles à combustibles suscitent un tel engouement, c'est parce qu'elles présentent de nombreux avantages primordiaux aujourd'hui :
- Elles produisent de très bons rendements énergétiques.
- Elles sont très peu ou pas polluantes (selon le combustible utilisé).
- Elles sont silencieuses.
- Elles prennent peu de place.
- Elles peuvent fonctionner à basse température.
- Elles demandent peu d'entretien.
Merci d'avance 
Bonjour,
1) Les demi équations sont les suivantes:
2 H+ + 2e-  H2.
H2.
4 H+ + O2 + 4e-  2(H2O).
2(H2O).
2) L'équation dans l'électrolyseur :
[ 2 H+ + 2e-  H2. ]
H2. ]  Il faut la multiplier par 2, pour ainsi éliminer les électrons.
Il faut la multiplier par 2, pour ainsi éliminer les électrons.
4 H+ + O2 + 4e-  2(H2O).
2(H2O).
Soit : 4 H+ + 4e-  2(H2)
2(H2)
4 H+ + O2 + 4e-  2(H2O)
2(H2O)
___________________________________________
2(H2O)  2(H2) + O2
2(H2) + O2  Les deux 4H+ ainsi que les deux 4e- se simplifient de part et d'autre.
Les deux 4H+ ainsi que les deux 4e- se simplifient de part et d'autre.
3) Le dioxygène est bien le réducteur d'après la formule : Ox + e-  red
red
4) Ok pour la schéma.
5) Cette pile produit un très bon rendement énergétique , elle ne pollue pas (ce qui est vraiment très important) , fonctionne à très basse température.
Cependant la production de dihydrogène émet du CO2 et il difficile à stocker (trop volumineux), coût trop important encore aujourd'hui.


